题目内容
13.设NA为阿伏加德罗常数的值.下列说法正确的是( )| A. | 1L0.1mol•L-1FeCl3溶液中含有的Fe3+离子数目为0.1NA | |
| B. | 常温常压下,4.6gNO2和N2O4混合物中含有的原子总数为0.3NA | |
| C. | 1mol (环己烷)中含有6NA共价键 (环己烷)中含有6NA共价键 | |
| D. | 常温下,2.24LCl2完全与NaOH溶液反应,转移的电子数目一定为0.1NA |
分析 A、Fe3+是弱碱阳离子,在溶液中会水解;
B、NO2和N2O4的最简式均为NO2;
C、环己烷中含6条碳碳单键和1条C-H键;
D、常温下气体摩尔体积大于22.4L/mol.
解答 解:A、Fe3+是弱碱阳离子,在溶液中会水解,故溶液中的铁离子的个数小于0.1NA个,故A错误;
B、NO2和N2O4的最简式均为NO2,故4.6g混合物中含有的NO2的物质的量为0.1mol,则含0.3mol原子即0.3NA个,故B正确;
C、环己烷中含6条碳碳单键和1条C-H键,故1mol环己烷中含18mol共价键即18NA个,故C错误;
D、常温下气体摩尔体积大于22.4L/mol,则2.24L氯气的物质的量小于0.1mol,则转移的电子数小于0.1NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案
相关题目
8.化学与生产、生活、社会等密切相关,下列说法正确的是( )
| A. | CO能使人中毒的原理是CO能将人体血液中的Fe2+氧化 | |
| B. | 雷雨过后感觉到空气清新是因为空气中产生了少量的二氧化氮 | |
| C. | 推广使用煤液化技术,可减少二氧化碳等温室气体的排放 | |
| D. | 利用铜、锶、钡等金属化合物的焰色反应制造节日烟花 |
18.下列除去杂质的方法正确的是( )
| A. | 除去乙醇中少量的乙酸:加足量生石灰,蒸馏 | |
| B. | 除去乙酸乙酯中少量的乙酸:用氢氧化钠溶液洗涤,分液、干燥、蒸馏 | |
| C. | 除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶 | |
| D. | 除去乙烷中少量的乙烯:光照条件下通入Cl2,使乙烯转化成液态二氯乙烷而与乙烷分离 |
5.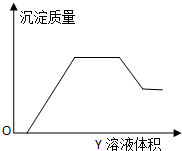 向甲溶液中缓慢滴加乙溶液,反应生成沉淀的质量如图所示,其中符合图象的是( )
向甲溶液中缓慢滴加乙溶液,反应生成沉淀的质量如图所示,其中符合图象的是( )
 向甲溶液中缓慢滴加乙溶液,反应生成沉淀的质量如图所示,其中符合图象的是( )
向甲溶液中缓慢滴加乙溶液,反应生成沉淀的质量如图所示,其中符合图象的是( )| 甲 | 乙 | |
| A | AlCl3、Mg(NO3)2、HNO3 | NaOH |
| B | Na2CO3、NH4HCO3、Na2SO4 | Ba(OH)2 |
| C | NH4NO3、Al(NO3)3、Fe(NO3)3、HCl | NaOH |
| D | NaAlO2、氨水、NaOH | H2SO4 |
| A. | A | B. | B | C. | C | D. | D |
2.浓度均为0.1mol/L的三种溶液:①氨水②盐酸③氯化铵溶液,下列说法不正确( )
| A. | PH由大到小的顺序:②>③>① | B. | 水电离的C(H+):③>①>② | ||
| C. | C(NH4+):③>① | D. | ①②等体积混合后的溶液:C(H+)>C(OH-) |
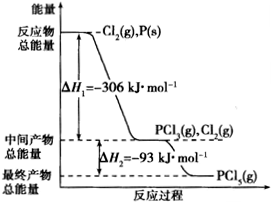 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中△H的表示生成1mol产物的数据).
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中△H的表示生成1mol产物的数据).