题目内容
2.浓度均为0.1mol/L的三种溶液:①氨水②盐酸③氯化铵溶液,下列说法不正确( )| A. | PH由大到小的顺序:②>③>① | B. | 水电离的C(H+):③>①>② | ||
| C. | C(NH4+):③>① | D. | ①②等体积混合后的溶液:C(H+)>C(OH-) |
分析 A.氨水的pH大于7,盐酸为强酸,氯化铵为强酸弱碱盐,溶液的pH小于7,但大于盐酸;
B.氨水和盐酸都抑制了是的电离,盐酸为强酸,抑制程度大于氨水;氯化铵电离出的铵根离子促进了水的电离;
C.氯化铵电离生成铵根离子,而氨水的电离程度很小;
D.①和②等体积混合后为氯化铵溶液,铵根离子部分水解,溶液呈酸性.
解答 解:A.浓度相同的三种溶液,①氨水为弱碱,溶液的pH>7,②盐酸为强酸,溶液的pH最小,③氯化铵强酸弱碱盐,其溶液的pH<7,但大于②的pH,所以三种溶液的pH大小为:①>③>②,故A错误;
B.氨水和盐酸都抑制了是的电离,盐酸为强酸,抑制程度大于氨水,则盐酸中水电离出的氢离子浓度小于氨水;氯化铵溶液中,铵根离子部分水解,促进了水的电离,所以三种溶液中水电离出的氢离子浓度大小为:③>①>②,故B正确;
C.氯化铵为强电解质完全电离后产生大量的NH4+,氨水为弱电解质只有少量的NH4+产生,则c(NH4+)为③>①,故C正确;
D.①②等体积混合后的溶液中,溶质为氯化铵,铵根离子部分水解,溶液显示酸性,则c(H+)>c(OH-),故D正确;
故选A.
点评 本题综合考查弱电解质的电离、盐类的水解以及离子浓度大小比较等相关知识,题目难度中等,明确弱电解质的电离平衡及盐的水解原理为解答关键,试题培养了学生得到分析能力及灵活应用能力.

练习册系列答案
相关题目
12.下列事实不能用勒沙特列原理解释的是( )
①铁在潮湿的空气中容易生锈;
②实验室可用排饱和食盐水的方法收集氯气;
③常温下,将1mL pH=3的醋酸溶液加水稀释至100mL,测得其pH<5;
④钠与氯化钾共融制备钾Na(1)+KCl(1)K(g)+NaCl(1);
⑤二氧化氮与四氧化二氮的平衡体系,加压后颜色加深.
①铁在潮湿的空气中容易生锈;
②实验室可用排饱和食盐水的方法收集氯气;
③常温下,将1mL pH=3的醋酸溶液加水稀释至100mL,测得其pH<5;
④钠与氯化钾共融制备钾Na(1)+KCl(1)K(g)+NaCl(1);
⑤二氧化氮与四氧化二氮的平衡体系,加压后颜色加深.
| A. | 只有①②③ | B. | 只有①⑤ | C. | 只有③④⑤ | D. | 只有②⑤ |
13.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1L0.1mol•L-1FeCl3溶液中含有的Fe3+离子数目为0.1NA | |
| B. | 常温常压下,4.6gNO2和N2O4混合物中含有的原子总数为0.3NA | |
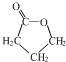
| C. | 1mol (环己烷)中含有6NA共价键 (环己烷)中含有6NA共价键 | |
| D. | 常温下,2.24LCl2完全与NaOH溶液反应,转移的电子数目一定为0.1NA |
7.“神舟九号”在2012年6月18 号与“天宫一号”进行交会对接,宇航员进入“天宫一号”生活了10余天,之后飞船于6月29日在内蒙古顺利着陆.在航天工业上应用了许多尖端合成材料,下列不属于合成材料的是( )
| A. | 光导纤维 | B. | 硅橡胶 | C. | 合成纤维 | D. | 黏合剂 |
11.下列有关化学用语表示正确的是( )
| A. | “碳铵”的化学式:(NH4)2CO3 | |
| B. | 二氧化碳的结构式:O=C=O | |
| C. | 钾原子的结构示意图: | |
| D. | 中子数为138、质子数为88的镭(Ra)原子:${\;}_{88}^{138}$Ra |
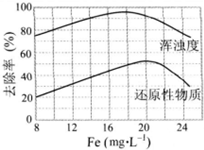 FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3 高效,且腐蚀性小.请回答下列问题:
FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3 高效,且腐蚀性小.请回答下列问题: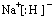 ;D在元素周期表中的位置为第三周期ⅢA族.
;D在元素周期表中的位置为第三周期ⅢA族.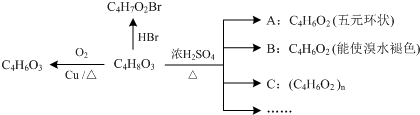
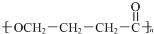 .
. +H2O.
+H2O. .
.