题目内容
5.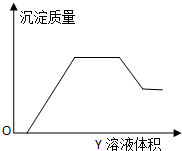 向甲溶液中缓慢滴加乙溶液,反应生成沉淀的质量如图所示,其中符合图象的是( )
向甲溶液中缓慢滴加乙溶液,反应生成沉淀的质量如图所示,其中符合图象的是( )| 甲 | 乙 | |
| A | AlCl3、Mg(NO3)2、HNO3 | NaOH |
| B | Na2CO3、NH4HCO3、Na2SO4 | Ba(OH)2 |
| C | NH4NO3、Al(NO3)3、Fe(NO3)3、HCl | NaOH |
| D | NaAlO2、氨水、NaOH | H2SO4 |
| A. | A | B. | B | C. | C | D. | D |
分析 由图象可知,先加入乙溶液时,没有沉淀生成,随着乙的增加,沉淀的质量逐渐增大,当沉淀增大到最大值时,沉淀质量不变,继续加入乙,沉淀质量逐渐减少,但沉淀不能完全溶解,结合对应物质的性质解答该题.
解答 解:A.甲:AlCl3、Mg(NO3)2、HNO3;乙:NaOH:将氢氧化钠加入AlCl3、Mg(NO3)2、HNO3的过程中,图象中间一段沉淀不变的反应不存在,与图象变化不相符,故A错误;
B.Ba(OH)2将加入Na2CO3、NH4HCO3、Na2SO4溶液中,不存在沉淀部分溶解的反应,与图象变化不相符,故B错误;
C.第一段是与盐酸反应,第二段与Al(NO3)3、Fe(NO3)3产生2种沉淀,第三段与NH4NO3反应,第四段是溶解氢氧化铝,符合图象曲线的变化,故C正确;
D.将H2SO4加入NaAlO2、氨水、NaOH的混合液中,最终沉淀会全部溶解,与图象变化不相符,故D错误;
故选C.
点评 本题考查离子反应及其综合应用,题目难度中等,明确常见离子的性质为解答关键,注意金属及其化合物是重要的无机物,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
15.下列依据相关实验得出的结论正确的是( )
| A. | 向AlCl3溶液中滴加氨水,产生白色沉淀;再加入过量NaHSO4溶液,沉淀消失 | |
| B. | 向盛有Fe(NO3)2溶液的试管中加入0.1 mol•L-1H2SO4溶液,试管口出现红棕色气体,说明溶液中NO3-被Fe2+还原为NO2 | |
| C. | 将某气体通入品红溶液中,品红褪色,说明该气体一定是SO2 | |
| D. | 将CO2通入BaCl2溶液中至饱和,无沉淀产生;再通入SO2,产生沉淀 |
16.经测定某溶液中只含NH4+、C1-、H+、OH-四种离子,下列说法错误的是( )
| A. | 溶液中四种粒子之间不可能满足:c(C1-)>c(H+)>c(NH4+)>c(OH-) | |
| B. | 若溶液中粒子间满足:c(NH4+)>c(C1-)>c(OH-)>c(H+)则溶液中溶质一定为:NH4Cl和NH3•H2O,且溶液pH>7 | |
| C. | 若溶液中粒子间满足:c(C1-)>c(NH4+)>c(H+)>c(OH-)溶液中溶质可能是NH4Cl | |
| D. | 若溶液中c(NH4+)=c(Cl-),则该溶液一定显中性 |
13.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1L0.1mol•L-1FeCl3溶液中含有的Fe3+离子数目为0.1NA | |
| B. | 常温常压下,4.6gNO2和N2O4混合物中含有的原子总数为0.3NA | |
| C. | 1mol (环己烷)中含有6NA共价键 (环己烷)中含有6NA共价键 | |
| D. | 常温下,2.24LCl2完全与NaOH溶液反应,转移的电子数目一定为0.1NA |
20.化学与生产、生活、社会密切相关.下列有关说法正确的是( )
| A. | 用聚合硫酸铁作为净水剂,该处理过程中仅发生了化学变化 | |
| B. | “血液透析”利用了胶体的性质 | |
| C. | 气象环境报告中的“PM2.5”是对一种新分子的描述 | |
| D. | 氢氧化钠可作胃酸的中和剂 |
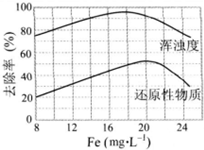 FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3 高效,且腐蚀性小.请回答下列问题:
FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3 高效,且腐蚀性小.请回答下列问题: ;D在元素周期表中的位置为第三周期ⅢA族.
;D在元素周期表中的位置为第三周期ⅢA族.
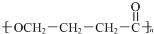 .
.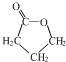 +H2O.
+H2O. .
.