题目内容
18.下列除去杂质的方法正确的是( )| A. | 除去乙醇中少量的乙酸:加足量生石灰,蒸馏 | |
| B. | 除去乙酸乙酯中少量的乙酸:用氢氧化钠溶液洗涤,分液、干燥、蒸馏 | |
| C. | 除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶 | |
| D. | 除去乙烷中少量的乙烯:光照条件下通入Cl2,使乙烯转化成液态二氯乙烷而与乙烷分离 |
分析 A.乙酸和氧化钙反应生成醋酸钙,乙醇不反应;
B.用氢氧化钠溶液洗涤乙酸乙酯会在氢氧化钠溶液中水解;
C.二氧化碳也会和碳酸钠反应被吸收;
D.光照条件下通入Cl2不能除去乙烯,应把混合气体通过溴水除去.
解答 解:A.除去乙醇中少量的乙酸:加足量生石灰,乙酸和氧化钙反应生成醋酸钙,乙醇不反应,通过蒸馏控制沸点把乙醇蒸馏出来,符合除杂原则,故A正确;
B.除去乙酸乙酯中少量的乙酸:用氢氧化钠溶液洗涤乙酸乙酯会在氢氧化钠溶液中水解,起不到除杂的作用,故B错误;
C.除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶,二氧化碳也会和碳酸钠反应被吸收,被提纯物质反应,故C错误;
D.除去乙烷中少量的乙烯,光照条件下通入Cl2不能除去乙烯,应把混合气体通过溴水除去,故D错误.
故选A.
点评 本题考查了物质的分离与除杂,难度不大,解决除杂问题时,抓住除杂质的必需条件(加入的试剂只与杂质反应,反应后不能引入新的杂质)是正确解题的关键.

练习册系列答案
相关题目
9.已知:H2(g)+Br2(g)=2HBr(g)△H=-72kJ/mol,1mol Br2(g)液化放出的能量为30kJ,其它相关数据如下表:则上述表格中的a值为( )
| 一定状态的分子 | H2(g) | Br2(l) | HBr(g) |
| 1mol该分子中的化学键断裂吸收的能量/kJ | 436 | a | 369 |
| A. | 404 | B. | 344 | C. | 260 | D. | 200 |
6.下列除杂方案正确的是( )
| 选项 | 被提纯的物质 | 杂质 | 除杂试剂 | 除杂方法 |
| A | CO2(g) | SO2(g) | 饱和NaHSO3溶液、浓H2SO4 | 洗气 |
| B | FeCl2(aq) | Fe3+(aq) | 足量铁粉 | 过滤 |
| C | Na2CO3(s) | NaHCO3(s) | 无需添加 | 灼烧 |
| D | Na2CO3(aq) | NaHCO3(aq) | 过量NaOH溶液 | 洗液 |
| A. | A | B. | B | C. | C | D. | D |
13.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1L0.1mol•L-1FeCl3溶液中含有的Fe3+离子数目为0.1NA | |
| B. | 常温常压下,4.6gNO2和N2O4混合物中含有的原子总数为0.3NA | |
| C. | 1mol (环己烷)中含有6NA共价键 (环己烷)中含有6NA共价键 | |
| D. | 常温下,2.24LCl2完全与NaOH溶液反应,转移的电子数目一定为0.1NA |
3.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 在1L 0.1mol/L的碳酸钠溶液中,氧原子总数为0.3 NA | |
| B. | 1molAl3+完全水解生成氢氧化铝胶体粒子的数目为NA | |
| C. | 常温常压下,32gO${\;}_{2}^{-}$中所含电子的数目为17NA | |
| D. | 标准状况下,11.2 L苯中含有分子的数目为0.5 NA |
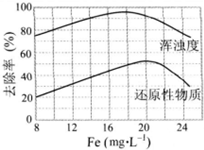 FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3 高效,且腐蚀性小.请回答下列问题:
FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3 高效,且腐蚀性小.请回答下列问题: