题目内容
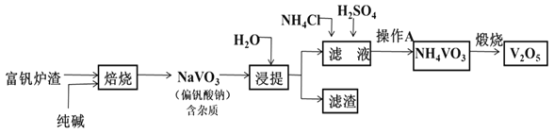
【题目】钒及其化合物在特种钢材的生产、高效催化剂的制备及航天工业中用途广泛。工业上以富钒炉渣(主要成分为V2O5,含少量Fe2O3和FeO等杂质)为原料提取五氧化二钒的工艺流程如图所示:
(1)五氧化二钒中钒的化合价为__。
(2)焙烧炉中发生的主要反应化学方程式为__;也可用氯化钠和氧气代替纯碱进行焙烧反应,写出对应的化学反应方程式__,该方法的缺点是:__。
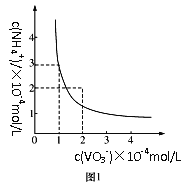
(3)已知NH4VO3难溶于水,在水中的Ksp曲线如图1所示,则在实验中进行操作A所需要的玻璃仪器有__;向10mL含NaVO30.2mol/L的滤液中加入等体积的NH4Cl溶液(忽略混合过程中的体积变化),欲使VO3-沉淀完全,则NH4Cl溶液的最小浓度为__。(当溶液中某离子浓度小于1×10-5mol/L时,认为该离子沉淀完全)
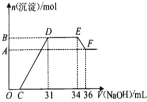
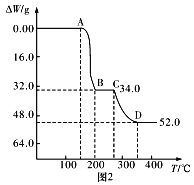
(4)为研究煅烧过程中发生的化学变化,某研究小组取234gNH4VO3进行探究,焙烧过程中减少的质量随温度变化的曲线如图2所示,则C点所得物质化学式为__,写出CD段发生反应的化学方程式:__。
【答案】+5价 V2O5+Na2CO3![]() 2NaVO3+CO2↑ 2V2O5+4NaCl+O2
2NaVO3+CO2↑ 2V2O5+4NaCl+O2![]() 4NaVO3+2Cl2 产生有毒气体氯气,污染环境 烧杯、漏斗和玻璃棒 0.206mol/L HVO3 2HVO3
4NaVO3+2Cl2 产生有毒气体氯气,污染环境 烧杯、漏斗和玻璃棒 0.206mol/L HVO3 2HVO3![]() V2O5+H2O
V2O5+H2O
【解析】
(1)富钒炉渣(主要成分为V2O5,含少量Fe2O3和FeO等杂质)加入纯碱焙烧,则发生V2O5与Na2CO3反应,生成NaVO3和CO2;加水浸提,此时NaVO3及过量的Na2CO3溶解在水中形成溶液,Fe2O3和FeO等不溶而成为滤渣。滤液中加入NH4Cl、H2SO4后,NaVO3与NH4Cl反应生成NH4VO3和NaCl,Na2CO3与H2SO4反应生成Na2SO4、H2O和CO2气体;因为NH4VO3难溶于水,所以过滤所得滤渣为NH4VO3,高温煅烧生成V2O5。
(2)提取坐标图象中的数据,可得出当c(NH4+)=1×10-4mol/L,溶解达平衡,此时c(VO3-)=3×10-4mol/L,由此可求出Ksp=1×10-4×3×10-4=3×10-8。加入NH4Cl溶液,作用有两个,一个是将VO3-转化为沉淀,另一个是使溶液中VO3-与NH4+的浓度积满足溶度积关系。
(3)在分析热重曲线时,先预测反应产物,再计算证实。NH4VO3热分解,应先生成酸,然后再再分解生成氧化物。
(1)五氧化二钒中,O显-2价,依据化合价的代数和为0,可求出钒的化合价为+5。答案为:+5;
(2)焙烧炉中,V2O5与Na2CO3反应生成NaVO3和CO2,发生反应的化学方程式为V2O5+Na2CO3![]() 2NaVO3+CO2↑;用氯化钠和氧气代替纯碱进行焙烧反应,则应生成NaVO3和Cl2,反应的化学方程式为2V2O5+4NaCl+O2
2NaVO3+CO2↑;用氯化钠和氧气代替纯碱进行焙烧反应,则应生成NaVO3和Cl2,反应的化学方程式为2V2O5+4NaCl+O2![]() 4NaVO3+2Cl2;从反应方程式可以看出,有Cl2生成,则该方法的缺点是:产生有毒气体氯气,污染环境。答案为:V2O5+Na2CO3
4NaVO3+2Cl2;从反应方程式可以看出,有Cl2生成,则该方法的缺点是:产生有毒气体氯气,污染环境。答案为:V2O5+Na2CO3![]() 2NaVO3+CO2↑;2V2O5+4NaCl+O2
2NaVO3+CO2↑;2V2O5+4NaCl+O2![]() 4NaVO3+2Cl2;产生有毒气体氯气,污染环境;
4NaVO3+2Cl2;产生有毒气体氯气,污染环境;
(3)从以上分析可知,操作A为过滤,所需要的玻璃仪器有烧杯、漏斗和玻璃棒;
由反应NaVO3+NH4Cl== NH4VO3↓NaCl,可求出反应所需n(NaVO3)=0.01L×0.2mol/L=2×10-3mol;由Ksp=3×10-8,c(VO3-)=1×10-5mol/L,可求出混合溶液中,c(NH4+)=3×10-3mol/L,则NH4Cl溶液的最小浓度为![]() =0.206mol/L。答案为:烧杯、漏斗和玻璃棒;0.206mol/L;
=0.206mol/L。答案为:烧杯、漏斗和玻璃棒;0.206mol/L;