题目内容
【题目】二氧化硫—空气质子交换膜燃料电池将化学能转变成电能的同时,实现了制硫酸、发电、环保三位一体的结合,降低了成本提高了效益,其原理如图所示。请回答下列问题:
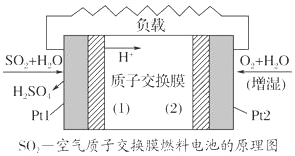
(1)Pt1电极附近发生的反应为______________________________
(2)Pt2电极附近发生的反应为______________________________
(3)该电池放电时电子从______电极经过外电路流到_____电极(填“Ptl”、“Pt2”)。
(4)相同条件下,放电过程中消耗的![]() 和
和![]() 的体积比为_____________。
的体积比为_____________。
【答案】SO2+2H2O2e═SO42+4H+ O2+4H++4e═2H2O Pt1 Pt2 2:1
【解析】
如图所示,由题意该装置为原电池装置,Pt1电极上![]() 转化为硫酸,硫元素化合价升高,失电子,发生氧化反应,Pt1为负极,则Pt2为正极,以此解题。
转化为硫酸,硫元素化合价升高,失电子,发生氧化反应,Pt1为负极,则Pt2为正极,以此解题。
(1)Pt1电极通入SO2,SO2在负极失电子生成SO42,则电极反应为SO2+2H2O2e═SO42+4H+,
答案为:SO2+2H2O2e═SO42+4H+;
(2)酸性条件下,氧气得电子生成水,则Pt2电极附近发生的反应为O2+4H++4e═2H2O,
答案为:O2+4H++4e═2H2O;
(3)原电池放电时,电子从负极流向正极,Pt1电极为负极,Pt2电极为正极,则该电池放电时电子从Pt1电极经过外电路流到Pt2电极,
答案为:Pt1;Pt2;
(4)该电池的原理为二氧化硫与氧气的反应,即2SO2+O2+2H2O=2H2SO4,所以放电过程中消耗的SO2和O2的体积之比为2:1,
答案为:2:1。

【题目】氯气是一种重要的工业原料,液氯储存区贴有的说明卡如下:
包装 | 钢瓶 |
储运要求 | 远离金属粉末、氨、烃类、醇类物质;设置氯气检测仪 |
泄漏处理 | NaOH、NaHSO3溶液吸收 |
下列解释事实的方程式不正确的是
A. 氯气用于自来水消毒:Cl2 + H2O![]() 2H+ + Cl-+ ClO-
2H+ + Cl-+ ClO-
B. 电解饱和食盐水制取Cl2:2Cl- +2H2O![]() 2OH-+ H2↑+Cl2↑
2OH-+ H2↑+Cl2↑
C. 浓氨水检验泄露的氯气,产生白烟:8NH3 + 3Cl2 === 6 NH4Cl + N2
D. 氯气“泄漏处理”中NaHSO3溶液的作用:HSO3-+ Cl2 + H2O === SO42-+ 3H+ + 2Cl-
【题目】目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行了探究。己知在不同温度下的化学平衡常数(K1、K2、K3)如表所示。
化学反应 | 焓变 | 平衡常数 | 温度/℃ | ||
500 | 700 | 800 | |||
①2H2(g)+CO(g) | △H1 | K1 | 2.5 | 0.34 | 0.15 |
②CO2(g)+H2(g)CO(g)+H2O(g) | △H2 | K2 | 1.0 | 1.70 | 2.52 |
③CO2(g)+3H2(g)CH3OH(g)+H2O(g) | △H3 | K3 | |||
请回答下列问题:
(1)反应②是_______(填“吸热”或“放热”)反应。
(2)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=_______(用K1、K2表示);根据反应③判断△S_______(填“>”“=”或“<”)0,在_______(填“较高”或“较低”)温度下有利于该反应自发进行。
(3)要使反应③在一定条件下建立的平衡逆向移动,可采取的措施有______(填字母,后同)。
A.缩小反应容器的容积 B.增大反应容器的容积
C.升高温度 D.使用合适的催化剂
E.从平衡体系中及时分离出CH3OH
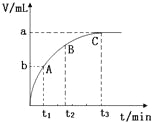
(4)500℃时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g的浓度分别为 0.1mol/L、0.8 mol/L、0.3 mol/L、0.15 mol/L,则此时v(正)_______v(逆) (填“>”“=”或“<”)。
(5)某兴趣小组研究反应②的逆反应速率在下列不同条件下随时间的变化曲线,开始时升高温度,t1时平衡,t2时减小压强,t3时增大CO的浓度,t4时又达到平衡。在下图中画出t2至t4的曲线。_____