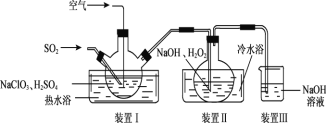
题目内容
【题目】在铜、锌、稀硫酸构成的原电池中(如图所示)
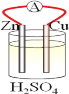
(1)负极是__________(填“铜”或“锌”),_________电子(填“失去”或“得到”),发__________(填“氧化”或 “还原”),电极反应方程式______________;
(2)电流由__________流向__________(填“铜”或“锌),铜片上观察到的现象是________________。
【答案】锌 失去 氧化 Zn-2e-=Zn2+ 铜 锌 铜片表面有气泡产生
【解析】
锌比铜活泼,形成原电池反应时,锌为负极,发生氧化反应,铜为正极,正极上氢离子得电子发生还原反应,电子从负极流向正极,阳离子从负极移向正极,以此解答。
(1)Zn、Cu、H2SO4构成原电池,由于金属活动性Zn>Cu,所以Zn为原电池的负极,失去电子,被氧化,发生氧化反应,负极的电极反应式为Zn-2e-=Zn2+;
(2)铜为正极,溶液中的H+在正极上得电子发生还原反应,2H++2e-=H2↑,会看到正极Cu片上不断产生气泡。电子从负极流向正极,阳离子从负极移向正极,由于电流方向为正电荷移动方向,所以电流从正极Cu经外电路流向负极Zn。

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
相关题目