题目内容
【题目】目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行了探究。己知在不同温度下的化学平衡常数(K1、K2、K3)如表所示。
化学反应 | 焓变 | 平衡常数 | 温度/℃ | ||
500 | 700 | 800 | |||
①2H2(g)+CO(g) | △H1 | K1 | 2.5 | 0.34 | 0.15 |
②CO2(g)+H2(g)CO(g)+H2O(g) | △H2 | K2 | 1.0 | 1.70 | 2.52 |
③CO2(g)+3H2(g)CH3OH(g)+H2O(g) | △H3 | K3 | |||
请回答下列问题:
(1)反应②是_______(填“吸热”或“放热”)反应。
(2)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=_______(用K1、K2表示);根据反应③判断△S_______(填“>”“=”或“<”)0,在_______(填“较高”或“较低”)温度下有利于该反应自发进行。
(3)要使反应③在一定条件下建立的平衡逆向移动,可采取的措施有______(填字母,后同)。
A.缩小反应容器的容积 B.增大反应容器的容积
C.升高温度 D.使用合适的催化剂
E.从平衡体系中及时分离出CH3OH
(4)500℃时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g的浓度分别为 0.1mol/L、0.8 mol/L、0.3 mol/L、0.15 mol/L,则此时v(正)_______v(逆) (填“>”“=”或“<”)。
(5)某兴趣小组研究反应②的逆反应速率在下列不同条件下随时间的变化曲线,开始时升高温度,t1时平衡,t2时减小压强,t3时增大CO的浓度,t4时又达到平衡。在下图中画出t2至t4的曲线。_____

【答案】 吸热 K1·K2 < 较低 B、C > 如图所示)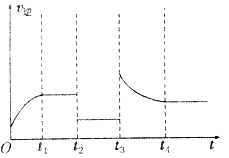
【解析】(1)反应②CO2(g)+H2(g)CO(g)+H2O(g)的平衡常数随温度升高增大,说明平衡正向进行,正反应是吸热反应;故答案为:吸热;
(2)反应③3H2(g)+CO2(g)═CH3OH(g)+H2O(g)是气体体积减小的反应△S<0,分析反应特征可知平衡常数K3=K1×K2,计算不同温度下反应③的平衡常数,500°C时,K3=K1×K2=2.5×1.0=2.5,800°C时,K3=K1×K2=2.5×0.15=0.375,结合温度变化分析,随温度升高,平衡常数减小,平衡逆向进行,所以判断反应是放热反应,焓变△H<0,要满足△G=△H-T△S<0,反应才能自发进行,则须在低温条件下能自发进行;故答案为:K1K2,<,较低;
(3)反应③3H2(g)+CO2(g) CH3OH(g)+H2O(g)是气体体积减小的放热反应,依据化学平衡移动原理分析。A.缩小反应容器的容积,压强增大,平衡正向进行,故A不符合;B.扩大反应容器的容积,压强减小,平衡逆向进行,故B符合;C.反应是放热反应,升高温度,平衡逆向进行,故C符合;D.使用合适的催化剂,改变反应速率不改变化学平衡,故D不符合;E.从平衡体系中及时分离出CH3OH,平衡正向进行,故E不符合;故答案为:BC;
(4)500℃时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度分别为0.1molL-1、0.8molL-1、0.3molL-1、0.15molL-1,Qc=![]() =0.88<K=2.5,则此时v正>v逆;故答案为:>;
=0.88<K=2.5,则此时v正>v逆;故答案为:>;
(5)反应②CO2(g)+H2(g)CO(g)+H2O(g)是气体体积不变的吸热反应,反应的逆反应速率在下列不同条件随时间的变化曲线,开始时升温,逆反应速率增大,t1时平衡,t2时降压,逆反应速率减小,平衡不变,t3时增加CO浓度,此时刻逆反应速率增大,随反应进行减小,大平衡状态大于t2-t3平衡状态的逆反应速率,t4时又达到平衡,依据反应速率影响分析绘制出去下变化;画出t2至t4的曲线为如图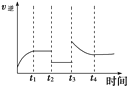 ;故答案为:
;故答案为: 。
。