题目内容
11.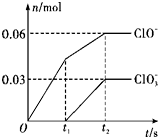 将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化关系如图所示.下列说法不正确的是( )
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化关系如图所示.下列说法不正确的是( )| A. | Cl2和苛性钾溶液在不同温度下可能发生不同反应 | |
| B. | 反应中转移电子数为是0.42 NA | |
| C. | 原苛性钾溶液中KOH的物质的量为0.3 mol | |
| D. | 生成物中Cl-的物质的量为0.21 mol |
分析 由图可知,t2时,n(ClO-)=0.06mol,n(ClO3-)=0.03mol,t1时溶液中不存在ClO3-,由电子守恒可知,Cl元素得到电子转化为Cl-,由电子转移守恒可知生成的氯离子n(Cl-)=0.06mol×(1-0)+0.03mol×(5-0)=转移电子物质的量,根据物料守恒可知n(K+)=n(Cl-)+n(ClO-)+n(ClO3-),以此来解答.
解答 解:A.由图可知,t2时,n(ClO-)=0.06mol,n(ClO3-)=0.03mol,t1时溶液中不存在ClO3-,则Cl2和苛性钾溶液在不同温度下可能发生不同反应,故A正确;
B.由电子转移守恒可知,转移电子=失去电子=0.06mol×(1-0)+0.03mol×(5-0)=0.21mol,故B错误;
C.物料守恒可知n(K+)=n(Cl-)+n(ClO-)+n(ClO3-)=0.21mol+0.06mol+0.03mol=0.3mol,故C正确;
D.n(Cl-)=0.06mol×(1-0)+0.03mol×(5-0)=0.21mol,故D正确;
故选B.
点评 本题考查氧化还原反应的计算,为高频考点,注意图中只体现Cl元素的化合价升高,把握电子守恒、物料守恒为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
1.能正确表示下列反应的离子方程式是( )
| A. | a mol FeI2溶液中通入2a mol Cl2:2Fe2++4I-+3Cl2═2I2+2Fe3++6C1- | |
| B. | 碳酸氢铵溶液中加入足量氢氧化钡溶液:NH4++HCO3-+2OH-═CO32-+NH3•H2O+H2O | |
| C. | Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 | |
| D. | 硅酸钠溶液中通入过量的CO2:SiO32-+CO2+H2O═H2SiO3↓+CO32- |
2.下列变化不属于氮的固定的是( )
| A. | N2→NH3 | B. | NH3→NH4Cl | C. | N2→NO | D. | NO→NO2 |
19.根据下列各物质的物理性质,判断其固态肯定不属于分子晶体的是( )
| A. | 溴化铝(无色晶体,熔点98℃,熔融态不导电) | |
| B. | 碳化铝(黄色晶体,熔点2200℃,熔融态不导电) | |
| C. | 氟化铝(无色晶体,熔融时或溶于水时破坏了相同的作用力) | |
| D. | 五氟化钒(无色晶体,熔点19.5℃,易溶于乙醇) |
3.下列说法正确的是( )
| A. | pH计(也叫酸度计)不可能用于酸碱中和滴定终点的判断 | |
| B. | 利用二氧化碳等原料合成的聚碳酸酯类可降解塑料替代聚乙烯塑料,可减少“白色污染”,聚碳酸酯是一种新型无机非金属材料 | |
| C. | 麦芽糖是高分子化合物,可以发生银镜反应,但是其水解产物不能发生银镜反应 | |
| D. | 石油在催化剂和加热条件下的结构重整是制取苯、甲苯等芳香烃的一种重要方法 |
20.下列说法不正确的是( )
| A. | 生物酶固氮相比人工固氮更高效、条件更温和 | |
| B. | 近日用地沟油炼制的生物航油载客首飞,标志着我国航空业在节能减排领域进入商业飞行阶段 | |
| C. | 分光光度计不能用于测定草酸与高锰酸钾的反应速率 | |
| D. | 尿液燃料电池的原理是在微生物作用下将尿液中的有机物转化为电能 |
1.化学中很多规律(性质)都有其适用范围,下列根据其推出的结论正确的是( )
| 选项 | 规律(或性质) | 结 论 |
| A | 主族元素最高正化合价等于族序数 | 第VⅡA族元素最高正价都是+7 |
| B | SO2和湿润的Cl2都有漂白性 | 二者混合后漂白性更强 |
| C | 常湿下铜与浓硝酸反应可以制取NO2 | 常温下铁与浓硝酸反应也可以制取NO2 |
| D | 较强酸可以制取较弱酸 | CO2通入NaClO溶液液中能生成HC10 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
 如图为向100mL 2mol/L AlCl3溶液中加入2mol/L NaOH溶液过程中,产生Al(OH)3白色沉淀的质量与NaOH的物质的量之间的关系曲线.试回答:
如图为向100mL 2mol/L AlCl3溶液中加入2mol/L NaOH溶液过程中,产生Al(OH)3白色沉淀的质量与NaOH的物质的量之间的关系曲线.试回答: