题目内容
1.能正确表示下列反应的离子方程式是( )| A. | a mol FeI2溶液中通入2a mol Cl2:2Fe2++4I-+3Cl2═2I2+2Fe3++6C1- | |
| B. | 碳酸氢铵溶液中加入足量氢氧化钡溶液:NH4++HCO3-+2OH-═CO32-+NH3•H2O+H2O | |
| C. | Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 | |
| D. | 硅酸钠溶液中通入过量的CO2:SiO32-+CO2+H2O═H2SiO3↓+CO32- |
分析 A.amol碘化亚铁中含有amol亚铁离子和2amol碘离子,完全反应最多消耗1.5mol氯气,说明氯气过量,亚铁离子和氯离子完全反应;
B.氢氧化钡足量,钡离子与碳酸根离子结合生成碳酸钡沉淀;
C.碘化氢过量,铁离子和硝酸根离子都氧化碘离子,漏掉了硝酸根离子与碘离子的反应;
D.二氧化碳过量,反应生成硅酸沉淀和碳酸氢钠,不是生成碳酸钠.
解答 解:A.a mol FeI2溶液中通入2a molCl2,amol碘化亚铁完全反应消耗1.5amol氯气,则氯气过量,亚铁离子和碘离子完全被氧化,反应的离子方程式为:2Fe2++4I-+3Cl2═2I2+2Fe3++6C1-,故A正确;
B.碳酸氢铵溶液中加入足量氢氧化钡溶液,反应生成碳酸钡沉淀、一水合氨和水,正确的离子方程式为:Ba2++NH4++HCO3-+2OH-═BaCO3↓+NH3•H2O+H2O,故B错误;
C.Fe(NO3)3溶液中加入过量的HI溶液,硝酸根离子在酸性条件下具有强氧化性,能够氧化碘离子,正确的离子方程式为:10I-+3NO3-+Fe3++12H+═5I2+3NO↑+Fe2++6H2O,故C错误;
D.硅酸钠溶液中通入过量的CO2,反应生成硅酸和碳酸氢钠,正确的离子方程式为:SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3-,故D错误;
故选A.
点评 本题考查了离子方程式的判断,为高考中的高频题,属于中等难度的试题,注意掌握离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.

练习册系列答案
相关题目
17.下表中对应关系正确的是( )
| A | 甲基橙溶液呈黄色的溶液,一定能大量存在的离子 | Na+、Fe3+、Cl-、SO42- |
| B | 在久置的氯水中能大量共存的微粒 | K+、Al3+、NO3-、HCOOH |
| C | 向明矾溶液中滴加Ba(OH)2溶液,恰好使Al3+沉淀完全: | 2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ |
| D | 1L0.1mol/LCuSO4溶液和足量的Ca充分反应 | 最终生成6.4gCu |
| A. | A | B. | B | C. | C | D. | D |
15.下列说法中正确的是( )
| A. | ${\;}_{8}^{16}$O、${\;}_{8}^{17}$O、${\;}_{8}^{18}$O互为同素异形体 | |
| B. | O2和O3互为同位素 | |
| C. | CH3-CH2-CH2-CH3与 互为同系物 互为同系物 | |
| D. |  与 与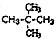 互为同分异构体 互为同分异构体 |
6.乙基香草醛(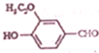 )是食品添加剂的增香原料,核磁共振氢谱表明该分子中不同类型的氢原子种类有( )
)是食品添加剂的增香原料,核磁共振氢谱表明该分子中不同类型的氢原子种类有( )
 )是食品添加剂的增香原料,核磁共振氢谱表明该分子中不同类型的氢原子种类有( )
)是食品添加剂的增香原料,核磁共振氢谱表明该分子中不同类型的氢原子种类有( )| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
13.下列有机物命名正确的是( )
| A. |  2-乙基丙烷 2-乙基丙烷 | B. | CH3CH2CH2OH 1-丁醇 | ||
| C. |  对二甲苯 对二甲苯 | D. |  2-甲基-2-丙烯 2-甲基-2-丙烯 |
11.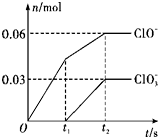 将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化关系如图所示.下列说法不正确的是( )
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化关系如图所示.下列说法不正确的是( )
 将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化关系如图所示.下列说法不正确的是( )
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化关系如图所示.下列说法不正确的是( )| A. | Cl2和苛性钾溶液在不同温度下可能发生不同反应 | |
| B. | 反应中转移电子数为是0.42 NA | |
| C. | 原苛性钾溶液中KOH的物质的量为0.3 mol | |
| D. | 生成物中Cl-的物质的量为0.21 mol |


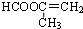 .
.