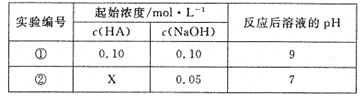
题目内容
【题目】一定条件下,向容积为 ![]() 的密闭容器中充入
的密闭容器中充入 ![]() 和
和 ![]() ,发生如下反应:
,发生如下反应:![]() ,
,![]() 后反应达到平衡时
后反应达到平衡时![]() 为
为 ![]() 。
。![]() 的平衡物质的量浓度
的平衡物质的量浓度![]() 与温度关系如图所示。下列说法错误的是
与温度关系如图所示。下列说法错误的是![]()

A.![]() ,
,![]() 的平均反应速率为
的平均反应速率为 ![]()
B.反应![]() 的
的![]()
C.在![]() 时,若反应处于状态D,则一定有
时,若反应处于状态D,则一定有![]()
D.若![]() 、
、![]() 时的平衡常数分别为
时的平衡常数分别为![]() 、
、![]() ,则
,则![]()
【答案】C
【解析】
![]() 的密闭容器中充入
的密闭容器中充入 ![]() 和
和 ![]() ,起始c(CO2)=
,起始c(CO2)=![]() =
= ![]() = 0.5mol/L, c(H2)=
= 0.5mol/L, c(H2)=![]() =
=![]() =1.5 mol/L
=1.5 mol/L

A.5min后反应达到平衡时![]() 为
为![]() ,所以参加反应的二氧化碳为:
,所以参加反应的二氧化碳为:![]() ,所以其反应速率为:
,所以其反应速率为:![]() ,故A正确,不符合题意;
,故A正确,不符合题意;
B.由图可知,温度越高平衡时![]() 越大,即升高温度平衡逆移,所以逆反应为吸热方向,正方向为放热方向,即
越大,即升高温度平衡逆移,所以逆反应为吸热方向,正方向为放热方向,即![]() ,故B正确,不符合题意;
,故B正确,不符合题意;
C.![]() 时反应进行到状态D,
时反应进行到状态D,![]() 高于平衡浓度,故反应向正反应进行,则一定有
高于平衡浓度,故反应向正反应进行,则一定有![]() 正
正![]() 逆
逆![]() ,故C错误,符合题意;
,故C错误,符合题意;
D.该反应正反应是放热反应,升高温度平衡向逆反应移动,所以升温化学平衡常数减小,故K![]() ,故D正确,不符合题意;
,故D正确,不符合题意;
答案选C。

【题目】请依据化学知识回答下列问题:
(1)实验测得0.16g CH4完全燃烧生成224mLCO2(标准状况)和0.36g液态水,并放出8.903kJ的热量。则CH4的燃烧热为________kJmol-1。
(2)碳酸锰热解制二氧化锰分两步进行:
i.MnCO3(s)![]() MnO(s)+CO2(g) H1=+a kJmol-1
MnO(s)+CO2(g) H1=+a kJmol-1
ii.2MnO (s)+ O2(g)![]() 2MnO2(s) H2=+b kJmol-1
2MnO2(s) H2=+b kJmol-1
请写出焙烧MnCO3制取MnO2的热化学方程式:______________________________________。
(3)下面是某同学探究可逆反应2NO2(g)![]() N2O4(g) H=-56.9 kJmol-1的部分实验报告,据此回答问题。
N2O4(g) H=-56.9 kJmol-1的部分实验报告,据此回答问题。

甲烧杯中NO2球的红棕色变浅。说明平衡2NO2(g)![]() N2O4(g)向________(填“正反应”或“逆反应”)方向移动,所以NH4NO3晶体溶于水是________(填“放热”或“吸热”)过程。
N2O4(g)向________(填“正反应”或“逆反应”)方向移动,所以NH4NO3晶体溶于水是________(填“放热”或“吸热”)过程。
(4)25°C时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
请依此判断CH3COOH、H2CO3、HClO的酸性由强到弱的顺序是________________________