题目内容
11.在一定条件下,16克A和22克B恰好反应生成C和4.5克D,在相同条件下,8克A和足量的B反应生成D和0.125 molC,从而可推知C的摩尔质量为134g/mol.分析 根据质量守恒定律计算16gA和22gB恰好反应生成C的质量,再根据质量定比关系计算8gA和足量B反应生成C的质量,根据M=$\frac{m}{n}$计算C的摩尔质量.
解答 解:16gA和22gB恰好反应生成C和4.5gD,根据质量守恒定律,生成C的质量为16g+22g-4.5g=33.5g,
故8gA和足量B反应生成0.125molC,C的质量为33.5g×$\frac{8g}{16g}$=16.75g,
故C的摩尔质量为$\frac{16.75g}{0.125mol}$=134g/mol,
故答案为:134g/mol.
点评 本题考查常用化学计量的有关计算、质量守恒定律等,难度不大,注意对基础知识的理解掌握.

练习册系列答案
相关题目
1.A、B、C、D、E、F为六种短周期元素,已知:它们的原子序数依次增大,A、B两种元素的核电荷数之差等于它们的原子最外层电子数之和;B原子最外层电子数比其次外层电子数多2;C是地壳中含量最高的元素;在元素周期表中,F和C是周期不同、族相邻的关系,且F和E的原子序数之和为30,它们两两形成的化合物为甲、乙、丙、丁、戊、,这五种化合物中原子个数比如下表:(用元素符号作答)
(1)写出F在周期表中的位置:第三周期VIIA族;
(2)向甲的水溶液中加入MnO2,氧化产物是O2(填化学式);已知有机物乙的分子为直线结构,乙的分子式为C2H2;
(3)若E单质可以与D的最高价氧化物的水化物溶液发生反应,请写出该反应化学方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
(4)以E单质为阳极,在H2SO4溶液中电解,可以在E表面形成致密氧化膜保护E材料不被腐蚀,写出阳极电极反应式为2Al+3H2O-6e-=Al2O3+6H+.
| 甲 | 乙 | 丙 | 丁 | 戊 | |
| 化合物中各元 素原子个数比 | A:C=1:1 | A:B=1:1 | D:C=1:1 | E:F=1:3 | B:F=1:4 |
(2)向甲的水溶液中加入MnO2,氧化产物是O2(填化学式);已知有机物乙的分子为直线结构,乙的分子式为C2H2;
(3)若E单质可以与D的最高价氧化物的水化物溶液发生反应,请写出该反应化学方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
(4)以E单质为阳极,在H2SO4溶液中电解,可以在E表面形成致密氧化膜保护E材料不被腐蚀,写出阳极电极反应式为2Al+3H2O-6e-=Al2O3+6H+.
2.下列有关反应的离子方程式书写正确的是( )
| A. | 将Na加入CuSO4溶液中:Na+Cu2+=Cu+2Na+ | |
| B. | 将NaHSO4溶液加入Ba(OH)2溶液中至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O | |
| C. | 向氯化铝溶液中加入足量氨水:AI3++4NH3•H2O=AIO2-+2H2O+4NH4+ | |
| D. | 向Ca(OH2)溶液中通入过量SO2:SO2+OH-=HSO3- |
19.现有四组物质:
①O2 N2 Cu Si ②HCl HBr H2S HNO3③CaO Na2O CuO Al2O3
④NH4Cl NaOH NaAlO2 K2CO3
(1)填写下表空白:
(2)表中的分类方法为B
A 树状分类法 B 交叉分类法
(3)若表中①②组物质反应生成0.6molNO,则转移的电子数目为0.18NA.起酸性作用的HNO3物质的量为1.8mol.
(4)写出表中③④组物质反应的离子方程式:Al2O3+2OH-=2AlO2-+H2O.
①O2 N2 Cu Si ②HCl HBr H2S HNO3③CaO Na2O CuO Al2O3
④NH4Cl NaOH NaAlO2 K2CO3
(1)填写下表空白:
| 组 | ①组 | ②组 | ③组 | ④组 |
| 分类标准 | 非金属 | 无氧酸 | 碱性氧化物 | |
| 异类物质 | NaOH |
A 树状分类法 B 交叉分类法
(3)若表中①②组物质反应生成0.6molNO,则转移的电子数目为0.18NA.起酸性作用的HNO3物质的量为1.8mol.
(4)写出表中③④组物质反应的离子方程式:Al2O3+2OH-=2AlO2-+H2O.
3.下列有关仪器的使用正确的是( )
| A. | 将固体药品放在蒸发皿中进行高温焙烧 | |
| B. | 配制480mLNaOH溶液需要的主要仪器有480mL容量瓶、玻璃棒、烧杯、量筒等 | |
| C. | 向试管中滴加液体时胶头滴管一定应悬于试管口的正上方 | |
| D. | 冷凝管中冷却水的流向一定是下口进水、上口出水 |
 3,3,5-三甲基庚烷
3,3,5-三甲基庚烷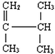 2,3-二甲基-1-丁烯
2,3-二甲基-1-丁烯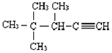 的系统名称为3,4,4-三甲基-1-戊炔.
的系统名称为3,4,4-三甲基-1-戊炔.