题目内容
1.某同学做同周期元素性质递变规律实验时,设计了实验方案,并记录了如下.| 实验方案 | 实验现象 |
| ①将镁带用砂纸擦后,放入试管中,加入少量水后,加热至水沸腾;再向反应后溶液中滴加酚酞 | (A)浮于水面,熔成一个小球,四处游动,发出“嘶嘶”声,随之消失,溶液变红色 |
| ②将一小块金属钠放入滴有酚酞试液的冷水反应 | (B)反应不十分剧烈,产生的气体可在空气中燃烧 |
| ③镁带与2mol/L的稀盐酸反应 | (C)剧烈反应,产生的气体可在空气中燃烧 |
| ④铝条与2mol/L的稀盐酸反应 | (D)生成白色胶状沉淀,继而沉淀消失 |
| ⑤向AlCl3溶液滴加NaOH溶液 | (E)产生大量气体,可在空气中燃烧,溶液变红色 |
(1)实验目的::探究同周期元素的金属性和非金属性的递变规律.
(2)实验内容:(填写与实验方案相对应的实验现象)
①E②A③C④B⑤D
(3)实验结论:同周期元素,从左到右,元素金属性逐渐减弱.
分析 (1)根据题意“某同学做同周期元素性质递变规律实验时”以及所做实验可以判断;
(2)根据反应物的性质、生成物的颜色、状态、溶液的酸碱性选取相应的实验现象;
(3)根据实验现象来分析实验的结论,涉及同周期元素金属性的递变规律.
解答 解:(1)本实验的实验目的是:探究同周期元素的金属性和非金属性的递变规律.
故答案为:探究同周期元素的金属性和非金属性的递变规律;
(2)①镁和沸水反应生成氢氧化镁和氢气,氢氧化镁在水中能电离出氢氧根离子使溶液呈碱性,但氢氧化镁的溶解性很小,所以滴有酚酞后溶液呈浅红色,故选E;
②将一小块金属钠放入滴有酚酞试液的冷水反应生成氢氧化钠和氢气,钠的密度小于水的密度,所以会浮在水面上;钠的熔点较低,钠和水反应放出大量热,钠熔成一个小球,钠和水反应很剧烈,发出“嘶嘶”声,氢氧化钠是易溶于水的碱,所以其水溶液呈红色,故选A;
③镁带与2mol/L的稀盐酸反应,盐酸中氢离子浓度较大,所以反应剧烈,产生可燃性气体,故选C;
④铝条与2mol/L的稀盐酸反应,盐酸和铝反应不如和镁反应剧烈,但反应时也生成可燃性气体,故选B;
⑤向AlCl3溶液滴加NaOH溶液,先生成Al(OH)3沉淀,加入NaOH至过量,继续反应生成NaAlO2而溶解,故选D;
故答案为:E;A;C;B;D;
(3)由实验可知金属性:Na>Mg>Al,则实验结论为同周期元素随原子序数增大,元素金属性逐渐减弱;
故答案为:同周期元素,从左到右,元素金属性逐渐减弱;
点评 本题考查学生利用实验来验证同周期元素性质的变化规律,明确金属性强弱的比较的方法和物质的性质是解题的关键,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.在无色透明的强酸性溶液中,下列各组离子能大量共存的是( )
| A. | NO3-、Cl-、Fe3+、K+ | B. | Cl-、Ag+、NO3-、Na+ | ||
| C. | SO42-、Al3+、Na+、Cl- | D. | NO3-、HCO3-、Na+、SO42- |
11.下列化合物中一定不含离子键的是( )
| A. | NaOH | B. | K2CO3 | C. | Na2O | D. | H2SO4 |
 3,3,5-三甲基庚烷
3,3,5-三甲基庚烷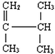 2,3-二甲基-1-丁烯
2,3-二甲基-1-丁烯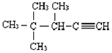 的系统名称为3,4,4-三甲基-1-戊炔.
的系统名称为3,4,4-三甲基-1-戊炔.