题目内容
【题目】化学链燃烧技术的基本原理是借助载氧剂(如Fe2O3,FeO等)将燃料与空气直接接触的传统燃烧反应分解为几个气固反应,燃料与空气无须接触,由载氧剂将空气中的氧气传递给燃料。回答下列问题:
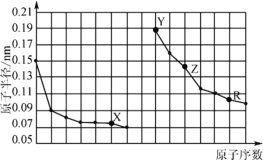
(1)用FeO作载氧剂,部分反应的lgKp与温度的关系如图所示。[已知:平衡常数Kp是用平衡分压(平衡分压=总压×物质的量分数)代替平衡浓度]

①图中涉及的反应中,属于吸热反应的是反应_________________(填字母)。
②R点对应温度下,向某恒容密闭容器中通入1.5 mol CO,并加入足量的FeO,只发生反应CO(g)+ FeO(s) ![]() CO2(g) +Fe(s),则CO的平衡转化率为______________
CO2(g) +Fe(s),则CO的平衡转化率为______________
(2)在T℃下,向某恒容密闭容器中加入2 mol CH4(g)和8 mol FeO(s)进行反应:CH4(g)+4FeO(s) ![]() 4Fe(s)+2H2O(g)+CO2(g)。反应起始时压强为P0,达到平衡状态时,容器的气体压强是起始压强的2倍。
4Fe(s)+2H2O(g)+CO2(g)。反应起始时压强为P0,达到平衡状态时,容器的气体压强是起始压强的2倍。
①T℃下,该反应的Kp = ______________
②若起始时向该容器中加入1molCH4(g),4molFeO(s),1mol H2O(g),0.5molCO2(g),此时反应向__________________(填“正反应”或“逆反应”)方向进行。
③其他条件不变,若将该容器改为恒压密闭容器,则此时CH4的平衡转化率___________(填“增大” “减小”或“不变”)。
(3)一种微胶囊吸收剂,将煤燃烧排放的CO2以安全、高效的方式处理掉,胶囊内部充有Na2CO3溶液,其原理如图所示。
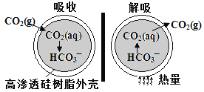
①这种微胶囊吸收CO2的原理是___________________(用离子方程式表示)。
②在吸收过程中当n(CO2):n(Na2CO3)=1:3时,溶液中c(CO32-)_____c(HCO3-)(填“>”、“ <”或“=”)
③将解吸后的CO2催化加氢可制取乙烯。
已知:C2H4(g)+3O2(g)=2CO2(g)+2H2O(g) △H1= -1323kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H2= -483.6kJ·mol-1
2CO2(g)+6H2(g)=C2H4(g)+4H2O(g) △H3=_______________
【答案】bc 50% ![]() 正反应 增大 CO2 + CO32 + H2O= 2HCO3- < 127.8kJ·mol1
正反应 增大 CO2 + CO32 + H2O= 2HCO3- < 127.8kJ·mol1
【解析】
(1)①图中涉及的反应中,反应是吸热反应,升高温度,平衡正向移动,则平衡常数变大;②R点的平衡常数,得出c(CO)与c(CO2)关系,根据关系计算转化的CO的物质的量,再计算CO的平衡转化率。
(2)建立三段式,再根据压强之比等于气体物质的量之比,根据反应后物质的量总和计算消耗量,再根据平衡常数进行计算;②根据浓度商进行计算结果与平衡常数比较;③若将该容器改为恒压密闭容器,压强减小,平衡向体积增加方向移动。
(3)①微胶囊吸收CO2的原理是CO2与Na2CO3溶液反应生成NaHCO3;②得出反应后溶液中溶质,再根据浓度关系分析离子浓度大小关系;③盖斯定律分析将第2个方程式加乘以3再减去第1个方程式。
(1)①图中涉及的反应中,反应是吸热反应,升高温度,平衡正向移动,则平衡常数变大,即反应bc是吸热反应,故答案为:bc。
②R点对应温度下,向某恒容密闭容器中通入1.5 mol CO,并加入足量的FeO,只发生反应CO(g)+ FeO(s) ![]() CO2(g) +Fe(s),lgKp=0,Kp=1,即c(CO)= c(CO2),由于是等体积反应,因此转化的CO的物质的量等于生成的CO2的物质的量还等于剩余的CO的物质的量即转化的CO的物质的量为0.75mol,则CO的平衡转化率为
CO2(g) +Fe(s),lgKp=0,Kp=1,即c(CO)= c(CO2),由于是等体积反应,因此转化的CO的物质的量等于生成的CO2的物质的量还等于剩余的CO的物质的量即转化的CO的物质的量为0.75mol,则CO的平衡转化率为![]() ,故答案为:50%。
,故答案为:50%。
(2)在T℃下,向某恒容密闭容器中加入2 mol CH4(g)和8 mol FeO(s)进行反应:CH4(g)+4FeO(s) ![]() 4Fe(s)+2H2O(g)+CO2(g)。反应起始时压强为P0,达到平衡状态时,容器的气体压强是起始压强的2倍,根据压强之比等于物质的量之比,压强是原来的2倍,则物质的量为原来的2倍。
4Fe(s)+2H2O(g)+CO2(g)。反应起始时压强为P0,达到平衡状态时,容器的气体压强是起始压强的2倍,根据压强之比等于物质的量之比,压强是原来的2倍,则物质的量为原来的2倍。

![]() ,x = 1
,x = 1
①T℃下,该反应的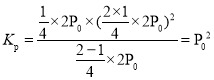 ,故答案为:
,故答案为:![]() 。
。
②若起始时向该容器中加入1molCH4(g),4molFeO(s),1mol H2O(g),0.5molCO2(g),此时的压强是开始溶液压强的![]() ,此时
,此时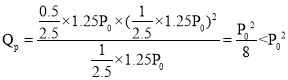 ,则反应向正反应方向进行;故答案为:正反应。
,则反应向正反应方向进行;故答案为:正反应。
③其他条件不变,若将该容器改为恒压密闭容器,压强减小,平衡向体积增加方向即正向移动,则CH4的平衡转化率增大;故答案为:增大。
(3)①这种微胶囊吸收CO2的原理是CO2与Na2CO3溶液反应生成NaHCO3,其离子方程式为CO2 + CO32 + H2O= 2HCO3-;故答案为:CO2 + CO32 + H2O= 2HCO3-。
②在吸收过程中当n(CO2):n(Na2CO3)=1:3时,则反应后溶液中溶质为Na2CO3、NaHCO3,两者浓度相等,由于CO32水解程度大且生成HCO3-,因此溶液中c(CO32-) < c(HCO3-);故答案为: <。
③将第2个方程式加乘以3再减去第1个方程式得到2CO2(g)+6H2(g)=C2H4(g)+4H2O(g) △H3=127.8kJ·mol1,故答案为:127.8kJ·mol1。