题目内容
【题目】氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。

(1)氢氧燃料电池的能量转化主要形式是___,在导线中电子流动方向为___(用a、b和箭头表示)。
(2)正极反应的电极反应方程式为___。
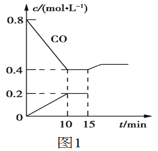
(3)氢气的制备和存储是氢氧燃料电池能否有效推广的关键技术。有人提出利用光伏发电装置电解尿素的碱性溶液来制备氢气。光伏发电是当今世界利用太阳能最主要方式之一。图1为光伏并网发电装置,图2为电解尿素[CO(NH2)2](C为+4价)的碱性溶液制氢的装置示意图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。

①图1中N型半导体为___(填“正极”或“负极”)
②该系统工作时,A极的电极反应式为___。
③若A极产生7.00gN2,则此时B极产生___LH2(标准状况下)。
【答案】化学能转化为电能 a→b O2+4e-+2H2O=4OH- 负极 CO(NH2)2+8OH--6e-= CO32-+N2↑+6H2O 16.8
【解析】
(1)氢氧燃料电池属于原电池;电子从负极沿导线流向正极;
(2)电解质溶液是碱,正极氧气得到电子生成氢氧根;
(3)根据化合价的变化结合电解池原理判断正负极;电池中,正极发生的反应一定是氧气得电子的过程;根据实际参加反应的氢气以及电极反应式计算。
(1)原电池的实质为化学能转化成电能。电解质溶液是碱,通入氧气的铂电极是正极,电子流动方向与电流流动的方向相反,电流从正极到负极,故电子流向为a→b;
(2)电解质溶液是碱,正极氧气得到电子生成氢氧根,电极反应方程式为:O2+4e-+2H2O=4OH-;
(3)①该电池反应时中,氮元素化合价由-3价变为0价,H元素化合价由+1价变为0价,则氮元素被氧化,氢元素被还原,所以生成氮气的电极A是阳极,生成氢气的电极B是阴极,则图1中N型半导体和B极相连,为负极;
②A是阳极,氮元素化合价由-3价变为0价,H元素化合价由+1价变为0价,则氮元素被氧化,氢元素被还原,电极方程式为:CO(NH2)2+8OH--6e-= CO32-+N2↑+6H2O;
③根据电子守恒有N2~3H2,则n(H2)=3n(N2)=3×![]() =0.75mol,标况下体积为V(H2)=0.75mol×22.4L/mol=16.8L。
=0.75mol,标况下体积为V(H2)=0.75mol×22.4L/mol=16.8L。

【题目】下列根据实验现象得出的结论正确的是![]()
选项 | 实验操作 | 现象 | 结论 |
A | 废 | 得到澄清溶液 | X中一定不含 |
B | 浓度均为 | 产生黑色沉淀 |
|
C |
| 试纸变为蓝色 |
|
D |
| 有机相呈橙色 | 氧化性: |
A.AB.BC.CD.D
【题目】下列转化及解释均正确的是( )
转化 | 解释 | |
A | CuS+H2SO4=CuSO4+H2S↑ | 酸性:H2SO4>H2S |
B | AgCl(s)+I-(aq)AgI(s)+Cl-(aq) | Kap(AgCl)<Kap(AgI) |
C | 2Fe+3Cl2 | 氧化性:Cl2>S |
D | C(s,石墨)=C(s,金刚石) △H=+1.9kJ/mol | 稳定性:石墨 |
A.AB.BC.CD.D