题目内容
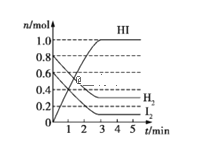
【题目】在某一容积为2 L的密闭容器内,加入0.8 mol H2和0.6 mol I2,在一定条件下发生反应:H2(g)+I2(g)2HI(g)ΔH<0。反应中各物质的物质的量随时间变化情况如图:
(1)该反应的化学平衡常数表达式为______,若升高温度,化学平衡常数K______(填“增大”、“减小”或“不变”)。
(2)根据图中数据,反应开始至达到平衡时,平均速率v(HI)=_____mol·L-1·min-1,转化率α(H2)=_____。
(3)HI的体积分数φ(HI)随时间变化如图中曲线Ⅱ所示。若改变反应条件,在甲条件下φ(HI)的变化如图中曲线Ⅰ所示,在乙条件下φ(HI)的变化如图中曲线Ⅲ所示。则甲条件可能是_____(填入下列条件的序号,下同),乙条件可能是______。
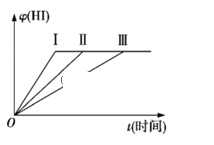
①恒容条件下,升高温度
②恒容条件下,降低温度
③恒温条件下,缩小反应容器体积
④恒温条件下,扩大反应容器体积
⑤恒温恒容条件下,加入适当催化剂
【答案】K=![]() 减小 0.167 62.5% ③⑤ ④
减小 0.167 62.5% ③⑤ ④
【解析】
本题考查化学平衡已到的影响因素及计算,图像分析注意拐点,先拐先平,说明其反应速率快,热化学中影响反应速率的因素有:浓度、温度、压强、催化剂依次分析。图像中HI的体积分数φ(HI)最终值一样,说明没有发生平衡的移动,只是速率的影响。
(1)H2(g)+I2(g)2HI(g)ΔH<0,应的平衡常数K=![]() ,反应为放热反应,升温平衡逆向进行,
,反应为放热反应,升温平衡逆向进行,
故答案为:K=![]() ;减小;
;减小;
(2)根据图中数据,由图象可知达到平衡时生成0.5mol/L的HI,反应开始至达到平衡时需要时间3min,平均速率v(HI)=0.5mol/L![]() 3min=0.167mol/(Lmin),由图象可知达到平衡时生成0.5molHI,则消耗0.25molH2,H2(g)的转化率为0.25mol
3min=0.167mol/(Lmin),由图象可知达到平衡时生成0.5molHI,则消耗0.25molH2,H2(g)的转化率为0.25mol![]() 0.4mol×100%=62.5%,
0.4mol×100%=62.5%,
故答案为:0.167;62.5%;
(3)曲线(Ⅰ)与曲线(Ⅱ)相比,到达平衡时间缩短,反应速率加快,平衡时HI体积发生不变,平衡不移动,可能使用催化剂,由于反应前后气体体积不变,也可能是增大压强,故选:③⑤;曲线(Ⅲ)与曲线(Ⅱ)相比,到达平衡时更长,反应速率减慢,平衡时HI体积发生不变,平衡不移动,由于反应前后气体体积不变,应是减小压强,故选④,
故答案为:③⑤;④;

 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案【题目】写出或完成下列热化学方程式。
(1)0.5molCH4完全燃烧生成CO2和液态水时,放出445kJ 的热量。写出CH4燃烧的热化学方程式__________。
(2)通常人们把拆开1mol某化学键吸收的能量看成该化学键的键能。下表是一些化学键的键能。
化学键 | C-H | C-F | H-F | F-F |
键能kJ/mol | 414 | 489 | 565 | 155 |
根据键能数据估算下列反应:CH4(g) + 4F2(g)=CF4(g) + 4HF(g)的反应热△H为_____。
(3)1840年瑞士的化学家盖斯(Hess)在总结大量实验事实(热化学实验数据)的基础上提出:“定压或定容条件下的任意化学反应,在不做其它功时,不论是一步完成的还是几步完成的,其热效应总是相同的(反应热的总值相等)。”
已知:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH1
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH2
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH3
请写出CO还原FeO的热化学方程式:______。
(4)在101KP下,1g氢气完全燃烧生成液态水放出142.9kJ的热量,请回答下列问题:
①氢气的燃烧热为__________;
②氢气燃烧热的热化学方程式为________;
(5)氢能的存储是氢能利用的前提,科学家研究出一种储氢合金Mg2Ni,已知:
Mg(s)+H2(g)=MgH2(s) ΔH1=-74.5kJ·mol-1;
Mg2Ni(s)+2H2(g)=Mg2NiH4(s) ΔH2;
Mg2Ni(s)+2MgH2(s)=2Mg(s)+Mg2NiH4(s) ΔH3=+84.6kJ·mol-1。
则ΔH2=_______kJ·mol-1;
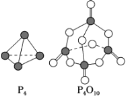
(6)白磷与氧气可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为P—P a kJ·mol-1、P—O b kJ·mol-1、P=O c kJ·mol-1、O=O d kJ·mol-1。根据图示的分子结构和有关数据估算该反应的ΔH为_____。
(7)同素异形体相互转化的反应热相当小而且转化速率较慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的”观点来计算反应热。已知:
①P4(白磷,s)+5O2(g)=P4O10(s) ΔH1=-2 983.2 kJ·mol-1
②P(红磷,s)+5/4O2(g)=1/4P4O10(s) ΔH2=-738.5 kJ·mol-1
相同状况下,能量较低的是________;白磷的稳定性比红磷________(填“大”或“小”)。
【题目】无水硫酸铜在加热至650℃时开始分解生成氧化铜和气体.某活动小组通过实验,探究不同温度下气体产物的组成.实验装置如下:
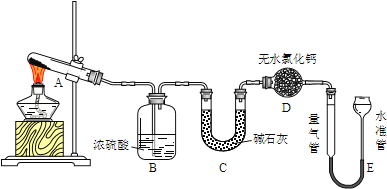
每次实验后均测定B、C质量的改变和E中收集到气体的体积.实验数据如下(E中气体体积已折算至标准状况):
实验组别 | 温度 | 称取CuSO4质量/g | B增重质量/g | C增重质量/g | E中收集到气体/mL |
① | T1 | 0.640 | 0.320 | 0 | 0 |
② | T2 | 0.640 | 0 | 0.256 | V2 |
③ | T3 | 0.640 | 0.160 | Y3 | 22.4 |
④ | T4 | 0.640 | X4 | 0.192 | 33.6 |
(1)实验过程中A中的现象是______.D中无水氯化钙的作用是_______.
(2)在测量E中气体体积时,应注意先_______,然后调节水准管与量气管的液面相平,若水准管内液面高于量气管,测得气体体积______(填“偏大”、“偏小”或“不变”).
(3)实验①中B中吸收的气体是_____.实验②中E中收集到的气体是______.
(4)推测实验②中CuSO4分解反应方程式为:_______.
(5)根据表中数据分析,实验③中理论上C增加的质量Y3=_______g.
(6)结合平衡移动原理,比较T3和T4温度的高低并说明理由________.