题目内容
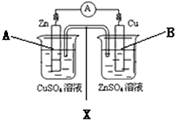
按下图装置进行实验,并回答下列问题

(1)判断装置的名称:B池为
(2)铜极为______极,电极反应式为
石墨棒C2附近发生的实验现象为
(3)当C2极析出224mL气体(标准状态时,锌的质量变化(增加或减少) g.
CuSO4溶液的质量变化了(增加或减少了) g .

(1)判断装置的名称:B池为
(2)铜极为______极,电极反应式为
石墨棒C2附近发生的实验现象为
(3)当C2极析出224mL气体(标准状态时,锌的质量变化(增加或减少) g.
CuSO4溶液的质量变化了(增加或减少了) g .
(共9分,前3空每空1分,其余各2分)
(1) 电解池 (2)正 Cu2+ + 2e- = Cu 有气泡冒出,溶液变红
(3)减少 0.65 增加 0.01
(1) 电解池 (2)正 Cu2+ + 2e- = Cu 有气泡冒出,溶液变红
(3)减少 0.65 增加 0.01
试题分析:(1)锌能和硫酸铜发生置换反应,所以根据装置结构特点可知,A是原电池,则B就是电解池。
(2)铜是正极,溶液中的铜离子得到电子,电极反应式是Cu2+ + 2e- = Cu。石墨棒C2和电源的负极相连,做阴极,溶液中的氢离子放电,同时破坏溶液中水的电离平衡,使阴极周围溶液显碱性,所以附近发生的实验现象为有气泡冒出,溶液变红。
(3)224ml气体是氢气,物质的量是0.01mol,则转移0.02mol电子,所以根据电子的得失守恒可知,消耗锌的物质的量是0.02mol÷2=0.01mol,质量是0.65g,即锌的质量减少0.65g。由于正极析出铜的质量是0.64g,所以溶液质量增加0.65g-0.64g=0.01g。
点评:该题是中等难度的试题,也是高考中的常见考点,试题基础性强,难易适中。主要是考查学生对电化学原理的了解掌握程度,有助于培养学生的逻辑思维能力,提高学生分析问题、特别是灵活运用基础知识解决实际问题的能力。

练习册系列答案
 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案
相关题目