题目内容
在由铜片、锌片和200mL稀硫酸组成的原电池中,若锌片中发生电化腐蚀,当铜片上共放出3.36L(标准状况)的气体时,H2SO4恰好用完,试计算:
⑴消耗锌的质量 ⑵通过导线的电子的物质的量 ⑶原硫酸的物质的量浓度。
⑴消耗锌的质量 ⑵通过导线的电子的物质的量 ⑶原硫酸的物质的量浓度。
⑴9.75g⑵0.30mol ⑶ 0.75 mol·L-1
试题分析:生成氢气的物质的量是3.36L÷22.4L/mol=0.15mol
则转移电子的物质的量是0.15mol×2=0.3mol
则根据电子得失守恒可知,消耗锌的物质的量是0.3mol÷2=0.15mol
所以消耗锌的质量是0.15mol×65g/mol=9.75g
根据氢原子守恒可知,原硫酸的物质的量是0.15mol
所以稀硫酸的浓度是0.15mol÷0.2L=0.75mol/L
点评:该题是基础性试题的考查,难度不大。试题基础性强,侧重对学生基础知识的巩固和训练,有利于培养学生的逻辑推理能力和规范答题能力,该题的关键是利用好几种守恒关系,即质量守恒定律、电子得失守恒和原子守恒等。

练习册系列答案
相关题目

 Zn2+
Zn2+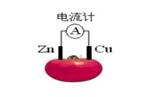
 电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是
电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是 。电池的总反应可表示为:
。电池的总反应可表示为:


 只向PbO2极移动
只向PbO2极移动

