题目内容
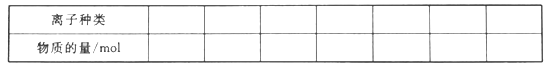
【题目】某混合溶液中,可能大量含有的离子如下表:

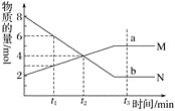
将Na2O2逐渐加入上述混合解液中并微热,产生沉淀和气体的物质的量与加入Na2O2的物质的量的关系分别如下图所示。

回答下列问题:
(1)将上述混合溶液中一定大量含有的阴、阳离子及其物质的量填入下表(可以不填满,也可以增加):_________
(2)图中a=_________,6=_________,c=_________
(3)简述溶液中还可能大量含有的离子的鉴定方法:_________________________
【答案】 1 7 9 用一根洁净的铂丝蘸取溶液,在酒精灯火焰上灼烧,透过蓝色的钴玻璃观察焰色,如果火焰呈紫色,则含有钾离子
1 7 9 用一根洁净的铂丝蘸取溶液,在酒精灯火焰上灼烧,透过蓝色的钴玻璃观察焰色,如果火焰呈紫色,则含有钾离子
【解析】
(1)根据离子之间反应的现象结合图示的数值来判断存在的离子以及量的情况;
(2)根据图象中所生成的气体和沉淀的量以及所加过氧化钠的量来计算各个点所对应的值;
(3)钾离子的检验可以做焰色反应实验。
(1)根据图象中沉淀的量的变化情况可以推知一定含有镁离子和铝离子,所以一定不含碳酸根离子、偏铝酸根离子,并且含有镁离子的物质的量为3mol,氢氧化铝和氢氧化镁沉淀一共是5mol,根据元素守恒,所以含有铝离子的物质的量2mol,根据生成气体的量的增加趋势,可以知道生成的气体除了过氧化钠和溶液反应生成的氧气之外,还一定有其他气体生成,只能是氨气,所以一定含有铵根离子,就一定不含有氢氧根离子,图象中加入过氧化钠的物质的量在0-amol之间时,所得沉淀量为0,所以溶液中含有![]() ,并且物质的量为2mol,溶液中一定得含有阴离子,那只有硫酸根了,所以一定含有硫酸根,钾离子不能确定是否存在,根据电荷守恒:所以
,并且物质的量为2mol,溶液中一定得含有阴离子,那只有硫酸根了,所以一定含有硫酸根,钾离子不能确定是否存在,根据电荷守恒:所以![]() ,所以硫酸根的物质的量≥8mol,故答案为:
,所以硫酸根的物质的量≥8mol,故答案为:
 ;
;
(2)含有2mol的氢离子需要消耗氢氧化钠2mol,则需要1mol过氧化钠来生成,所以a=1,含有镁离子和铝离子一共5mol,所以消耗过氧化钠的量为5mol,在加上a=2mol,则b=7mol,氯离子的物质的量是2mol,所以氢氧化铝的物质的量是2mol,完全将氢氧化铝溶解,消耗1mol的氢氧化钠,即需要1mol的过氧化钠来生成,所以c=9mol,故答案为:1;7;9;
(3)钾离子的检验常用焰色反应,做法是:用一根洁净的铂丝蘸取溶液,在酒精灯火焰上灼烧,透过蓝色的钴玻璃观察焰色,如果火焰呈紫色,则含有钾离子,故答案为:用一根洁净的铂丝蘸取溶液,在酒精灯火焰上灼烧,透过蓝色的钴玻璃观察焰色,如果火焰呈紫色,则含有钾离子。

 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案