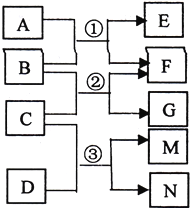
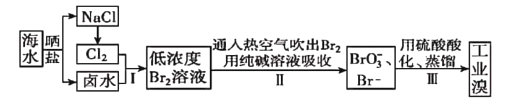
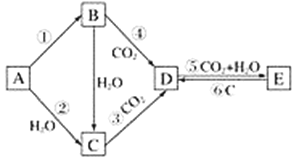
题目内容
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.25C时,1L pH=1的硫酸溶液中,含有H+的数目为0.2NA
B.标况下,22.4L Cl2与足量Fe和Cu混合物点燃,反应后,转移的电子数为2 NA个
C.50mL 12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA
D.标准状况下,11.2L SO3含有分子数为0.5NA
【答案】B
【解析】
A、pH=1的硫酸溶液中c(H+)=0.1mol/L,故1L该溶液中n(H+)=1L×0.1mol/L=0.1mol,N(H+)=0.1mol×NAmol-1=0.1NA,故A错误;
B、标况下,22.4L Cl2的物质的量为![]() =1mol,与足量Fe和Cu混合物点燃,氯元素化合价均降低为-1价,故转移电子数为1mol×2×NAmol-1=2NA,故B正确;
=1mol,与足量Fe和Cu混合物点燃,氯元素化合价均降低为-1价,故转移电子数为1mol×2×NAmol-1=2NA,故B正确;
C、浓盐酸与足量MnO2共热反应,随着反应的进行,盐酸浓度降低,后续反应将停止,故无法计算出具体转移电子数,故C错误;
D、标准状况下,SO3不是气体状态,故无法用气体摩尔体积计算其数目,故D错误。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案【题目】下图是某儿童微量元素体检报告单的部分数据,根据数据,回答下列问题:
北京市医疗机构临床检验结果报告单 | ||||
分析项目 | 检测结果 | 单位 | 参考范围 | |
1 | 锌(Zn) | 115.92 |
| 66~120 |
2 | 铁(Fe) | 6.95↓ |
| 7.52~11.82 |
3 | 钙(Ca) | 1.68 |
| 1.55~2.10 |
(1)该儿童体内_________元素含量偏低。
(2)报告单中“μmol·L-1”是__________(填“质量”“体积”或“浓度”)的单位。
(3)服用维生素C可使食物中的Fe3+转化为Fe2+。在这个过程中体现维生素C的________性。
(4)缺铁性贫血患者应补充Fe2+。一些补铁剂以硫酸亚铁为主要成分,将硫酸亚铁制成药片时外表包有一层特殊的糖衣,推测糖衣的作用是_______________________。
(5)取补血剂片用研钵研细,加入过量稀硫酸,取澄清液,然后滴加KSCN溶液,若溶液变为红色,则溶液中含有________(填离子符号),说明补血剂是否变质____________。
【题目】二氧化氯(ClO2)是极易溶于水且不与水发生化学反应的黄绿色气体,沸点为11℃,可用于处理含硫废水。某小组在实验室中探究ClO2与Na2S的反应。回答下列问题:
(1)ClO2的制备:
已知:SO2+NaClO3+H2SO4=2ClO2↑+2NaHSO4
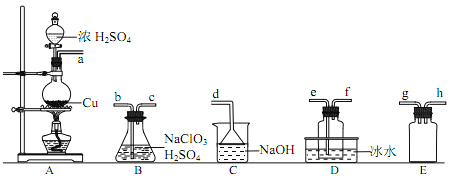
①装置A中反应的化学方程式为________________。
②欲收集干燥的ClO2,选择上图中的装置,其连接顺序为A→_______、_______、_______→C(按气流方向)。
③装置D的作用是_______________。
(2)ClO2与Na2S的反应
将上述收集到的ClO2用N2稀释以增强其稳定性,并将适量的稀释后的ClO2通入图所示装置中充分反应,得到无色澄清溶液。一段时间后,通过下列实验探究Ⅰ中反应的产物。
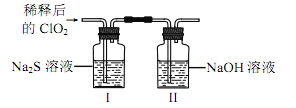
操作步骤 | 实验现象 | 结论 |
取少量I中溶液于试管甲中,滴加品红溶液和盐酸 | 品红始终不褪色 | ①无___生成 |
另取少量I中溶液于试管乙中,加入Ba(OH)2溶液,振荡 | ②____________ | 有SO42生成 |
③继续在试管乙中滴加Ba(OH)2溶液至过量,静置,取上层清液于试管丙内_________ | 有白色沉淀生成 | 有Cl生成 |
④ClO2与Na2S反应的离子方程式为___________。用于处理含硫废水时,ClO2相对于Cl2的优点是______________(任写一条)。