题目内容
【题目】如图所示为一定条件下含碘物质在水溶液中的转化关系图:

(1)转化①中的氧化剂是_____(填化学式)
(2)转化①②③中,碘元素发生氧化反应的是_____(填序号)
(3)转化③中,Cl2发生反应后可能生成以下物质中的_____(填字母)。
A HCl B HClO C.HClO4
(4)转化②的化学方程式为KIO3+KOH+SO2→I2+K2SO4+H2O(未配平)
①配平反应②并用双线桥法表示电子转移的情况_______________
②每生成1.27gI2,反应中转移电子的物质的量为_____
【答案】Cl2 ①③ A 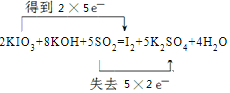 0.05mol
0.05mol
【解析】
(1)转化①为氯气与KI的反应,生成KCl和碘;
(2)①中I元素化合价由-1价升高到0价,②中I元素化合价由+5价降低到0价,③中I元素化合价由-1价升高到+5价;
(3)氯气与KI反应生成KIO3,氯气被还原,化合价由0价降低为-1价;
(4)反应KIO3+KOH+SO2→I2+K2SO4+H2O中,I元素化合价由+5价降低为0价,S元素化合价由+4价升高到+6价,结合化合价的变化解答。
(1)转化①为氯气与KI的反应,生成KCl和碘,氯气被还原,为氧化剂,故答案为:Cl2;
(2)①中I元素化合价由﹣1价升高到0价,②中I元素化合价由+5价降低到0价,③中I元素化合价由﹣1价升高到+5价,碘元素发生氧化反应的是①③,故答案为:①③;
(3)氯气与KI反应生成KIO3,氯气表现氧化性,被还原,化合价由0价降低为﹣1价,只有A符合,故答案为:A;
(4)①反应KIO3+KOH+SO2→I2+K2SO4+H2O中,I元素化合价由+5价降低为0价,S元素化合价由+4价升高到+6价,反应的方程式为2KIO3+8KOH+5SO2=I2+5K2SO4+4H2O,用双线桥法表示电子转移的情况可表示为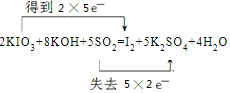 ,
,
故答案为: ;
;
②生成1.27gI2,物质的量为![]() =0.005mol,则转移的电子为0.005mol×2×(5﹣0)=0.05mol,
=0.005mol,则转移的电子为0.005mol×2×(5﹣0)=0.05mol,
故答案为:0.05mol。