��Ŀ����
����Ŀ��ʵ��̽����̽��̼����Ԫ�صķǽ����Ե����ǿ��������Ҫ��������и�С�⣮
��1��ʵ��װ�ã� 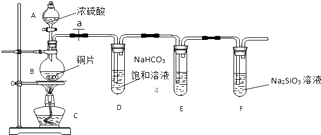
��д��ʾ��������AB
��2��ʵ�鲽�裺
��������������ҩƷ��a��Ȼ�����Ũ���ᣬ���ȣ�
��3������̽��������֪����ǿ���������̼�ᣩ
��ͭ��Ũ���ᷴӦ�Ļ�ѧ����ʽ����װ��E����������KMnO4��Һ������ǿ�����ԣ�����������
����˵��̼Ԫ�صķǽ����Աȹ�Ԫ�طǽ�����ǿ��ʵ����������
�������Թ�D�е�ʵ�������ܷ�֤����Ԫ�صķǽ�����ǿ��̼Ԫ�صķǽ���������ܡ������Թ�D�з�����Ӧ�����ӷ���ʽ�� ��
���𰸡�
��1����Һ©����Բ����ƿ
��2�����װ�õ�������
��3��Cu+2H2SO4��Ũ�� ![]() ?CuSO4+SO2��+2H2O����ȥSO2���壻ʢ��Na2SiO3��Һ���Թ��г��ְ�ɫ��������SO2+2HCO3��=SO32��+H2O+2CO2
?CuSO4+SO2��+2H2O����ȥSO2���壻ʢ��Na2SiO3��Һ���Թ��г��ְ�ɫ��������SO2+2HCO3��=SO32��+H2O+2CO2
���������⣺��1������װ��ͼ�е�������֪AΪ��Һ©����BΪԲ����ƿ�����Դ��ǣ���Һ©����Բ����ƿ����2����Ӧ�������壬�ڼ���ҩƷ֮ǰ��Ҫ����װ�õ������ԣ���ֹ�����Բ��õ�������й©�����Դ��ǣ����װ�õ������ԣ���3�����ڼ���������ͭ��Ũ���ᷴӦ���ɶ�����������ͭ��ˮ���䷴Ӧ����ʽΪ��Cu+2H2SO4��Ũ�� ![]() CuSO4+SO2��+2H2O������Ķ�������������KMnO4��Һ���գ���ֹ���ź�������飬���Դ��ǣ�Cu+2H2SO4��Ũ��
CuSO4+SO2��+2H2O������Ķ�������������KMnO4��Һ���գ���ֹ���ź�������飬���Դ��ǣ�Cu+2H2SO4��Ũ�� ![]() CuSO4+SO2��+2H2O����ȥSO2���壻�ڶ�����̼��Na2SiO3��Һ��Ӧ���ɹ��ᣬ֤����̼�����Աȹ���ǿ��˵��̼Ԫ�صķǽ����Աȹ�Ԫ�طǽ�����ǿ������ʢ��Na2SiO3��Һ���Թ��г��ְ�ɫ������˵��̼Ԫ�صķǽ����Աȹ�Ԫ�طǽ�����ǿ�����Դ��ǣ�ʢ��Na2SiO3��Һ���Թ��г��ְ�ɫ��������������ۺ����������ǿ���жϷǽ�����ǿ����������������ˮ���ɵ��������ᣬ������ۺ����ᣬ���Բ����жϷǽ�����ǿ�����Թ�D�з�����Ӧ�Ƕ���������̼���������ɶ�����̼�������ӷ���ʽΪ��SO2+2HCO3��=SO32��+H2O+2CO2 �� ���Դ��ǣ���SO2+2HCO3��=SO32��+H2O+2CO2 ��
CuSO4+SO2��+2H2O����ȥSO2���壻�ڶ�����̼��Na2SiO3��Һ��Ӧ���ɹ��ᣬ֤����̼�����Աȹ���ǿ��˵��̼Ԫ�صķǽ����Աȹ�Ԫ�طǽ�����ǿ������ʢ��Na2SiO3��Һ���Թ��г��ְ�ɫ������˵��̼Ԫ�صķǽ����Աȹ�Ԫ�طǽ�����ǿ�����Դ��ǣ�ʢ��Na2SiO3��Һ���Թ��г��ְ�ɫ��������������ۺ����������ǿ���жϷǽ�����ǿ����������������ˮ���ɵ��������ᣬ������ۺ����ᣬ���Բ����жϷǽ�����ǿ�����Թ�D�з�����Ӧ�Ƕ���������̼���������ɶ�����̼�������ӷ���ʽΪ��SO2+2HCO3��=SO32��+H2O+2CO2 �� ���Դ��ǣ���SO2+2HCO3��=SO32��+H2O+2CO2 ��
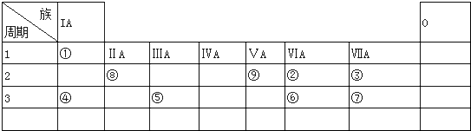
�����㾫�����������⣬������Ҫ�˽�ǽ�����Ԫ�����ڱ��е�λ�ü������ʵݱ�Ĺ���(��Ŀǰ��֪��112��Ԫ���У��ǽ���Ԫ����22�֣���H��ǽ���Ԫ�ض�λ�����ڱ������Ϸ���H�����Ϸ�����F�Ƿǽ�������ǿ��Ԫ��)��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�