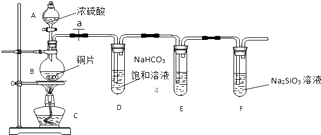
��Ŀ����
����Ŀ�������ʾΪԪ�����ڱ���һ���֣�����Ԫ�آ١����ڱ��е�λ�ã���ش��������⣺ 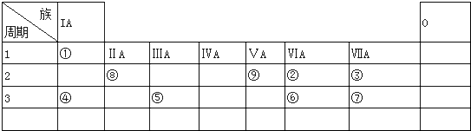
��1�����ڱ���Ԫ�������������ͼ۴�����Ϊ������壨������ű�ʾ����
��2���͢ߵ���ۺ����������ǿ��Ϊ������Ļ�ѧʽ��ʾ����
��3���١�������Ԫ�ذ�ԭ�Ӹ���֮��Ϊ1��1��ɵij���Һ̬�������������Һ���ܽ�Fe2+������д���÷�Ӧ�����ӷ���ʽ��
��4����֪���ڱ��д��ڶԽ����ƹ������루Be��������ѧ�������ƣ�����������������Ҳ�����ԣ�д���������������ܵ�����������ˮ���ﷴӦ�Ļ�ѧ����ʽ ��
��5����֪W+X=Y+Z����Ӧ��Ҫ���ȣ�����W��X��Y��Z�ֱ����ɢ٢ڢ�����Ԫ���γɵ�����ʮ�������ӣ�W��XΪ���ӣ�Y��ZΪ���ӣ���д���û�ѧ����ʽ ��
��6���ɱ���Ԫ���γɵ����ʿɷ�����ͼ�еķ�Ӧ������B��C��G�ǵ��ʣ�BΪ����ɫ���壬D��Һ�Լ��ԣ� 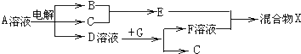
��д��D��Һ��G��Ӧ�Ļ�ѧ����ʽ ��
��д������A��Һ�����ʵ������ӵķ��� ��
���𰸡�
��1��IVA
��2��HClO4��H2SO4
��3��H2O2+2Fe2++2H+=2Fe3++2H2O
��4��Be��OH��2+2NaOH=Na2BeO2+2H2O
��5��NH4++OH�� ![]() NH3��+H2O
NH3��+H2O
��6��2Al+2NaOH+2H2O=2NaAlO2+3H2����ȡ����A��Һ�μӼ���ϡ�����ữ����������Һ�а�ɫ��������
���������⣺����Ԫ�������ڱ��е�λ�ã���֪��ΪH����ΪO����ΪF����ΪNa����ΪAl����ΪS����ΪCl����ΪBe����ΪN����1�����ڱ���Ԫ�������������ͼ۴�����Ϊ���Ԫ��λ��IVA�����Դ��ǣ�IVA����2���ǽ�����Cl��S���ǽ�����Խǿ����ۺ����������Խǿ�������ԣ�HClO4��H2SO4 �� ���Դ��ǣ�HClO4��H2SO4����3���١�������Ԫ�ذ�ԭ�Ӹ���֮��Ϊ1��1��ɵij���Һ̬������ΪH2O2 �� ��������Һ���ܽ�Fe2+����Fe3+ �� ͬʱ����ˮ����Ӧ���ӷ���ʽΪ��H2O2+2Fe2++2H+=2Fe3++2H2O�����Դ��ǣ�H2O2+2Fe2++2H+=2Fe3++2H2O����4���������������ǿ�Ӧ�����κ�ˮ����Ӧ�Ļ�ѧ����ʽΪBe��OH��2+2NaOH=Na2BeO2+2H2O�����Դ��ǣ�Be��OH��2+2NaOH=Na2BeO2+2H2O����5����֪W+X=Y+Z��W��X��Y��Z�ֱ����ɢ٢ڢ�����Ԫ���γɵ�����ʮ�������ӣ�Ӧ��Ϊ笠����������������ӵķ�Ӧ���÷�ӦʽΪNH4++OH�� ![]() NH3��+H2O�����Դ��ǣ�NH4++OH��
NH3��+H2O�����Դ��ǣ�NH4++OH�� ![]() NH3��+H2O����6���ɱ���Ԫ���γɵ����ʣ�����B��C��G�ǵ��ʣ�BΪ����ɫ���壬��BΪCl2 �� D��Һ�Լ��ԣ����A��ҺΪ����Ȼ�����Һ�����������������������ƣ���DΪNaOH��CΪH2 �� ��EΪHCl��G��������������Һ��Ӧ�õ��õ�������F����GΪAl��FΪNaAlO2 �� ��D��Һ��G��Ӧ�Ļ�ѧ����ʽΪ��2Al+2NaOH+2H2O=2NaAlO2+3H2�������Դ��ǣ�2Al+2NaOH+2H2O=2NaAlO2+3H2�����ڼ���NaCl��Һ�����ʵ������ӵķ�����ȡ����A��Һ�μӼ���ϡ�����ữ����������Һ�а�ɫ�������ɣ����Դ��ǣ�ȡ����A��Һ�μӼ���ϡ�����ữ����������Һ�а�ɫ�������ɣ�
NH3��+H2O����6���ɱ���Ԫ���γɵ����ʣ�����B��C��G�ǵ��ʣ�BΪ����ɫ���壬��BΪCl2 �� D��Һ�Լ��ԣ����A��ҺΪ����Ȼ�����Һ�����������������������ƣ���DΪNaOH��CΪH2 �� ��EΪHCl��G��������������Һ��Ӧ�õ��õ�������F����GΪAl��FΪNaAlO2 �� ��D��Һ��G��Ӧ�Ļ�ѧ����ʽΪ��2Al+2NaOH+2H2O=2NaAlO2+3H2�������Դ��ǣ�2Al+2NaOH+2H2O=2NaAlO2+3H2�����ڼ���NaCl��Һ�����ʵ������ӵķ�����ȡ����A��Һ�μӼ���ϡ�����ữ����������Һ�а�ɫ�������ɣ����Դ��ǣ�ȡ����A��Һ�μӼ���ϡ�����ữ����������Һ�а�ɫ�������ɣ�

 ȫ��������ϵ�д�
ȫ��������ϵ�д� һ��һ����ʱ���ϵ�д�
һ��һ����ʱ���ϵ�д�