题目内容
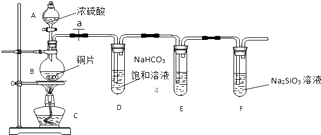
【题目】“粗盐提纯”实验中,下列操作正确的是( )
A. 过滤时用玻璃棒搅拌漏斗内的液体,以加速过滤
B. 蒸发到析出晶体时才需要用玻璃棒搅拌
C. 当蒸发皿中出现较多量晶体时就应停止加热
D. 待溶液蒸干后即停止加热
【答案】C
【解析】
A.在过滤时,不能用玻璃棒在漏斗中进行搅拌,防止弄坏滤纸,故A错误;
B.蒸发过程中要不断用玻璃棒搅拌,防止局部温度过高而产生安全事故,故B错误;
C.蒸发皿中出现较多晶体时,就停止加热,利用余热蒸干晶体,故C正确;
D.蒸发皿中出现较多晶体时,就停止加热,利用余热蒸干晶体,故D错误。
故选C。

练习册系列答案
相关题目
【题目】如表列出了A~R九种元素在周期表的位置:
主族 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | E | R | F | |||||
3 | A | C | D | H | I | G | ||
4 | B |
(1)写出R单质分子的电子式 .
(2)A、C、D三种元素的氧化物对应的水化物中碱性最强的是(填化学式).
(3)A,B,C三种元素的阳离子按离子半径由大到小的顺序排列为 . (用元素的离子符号表示).
(4)写出A的单质与水反应的离子方程式 .
(5)X元素是A~R九种元素中的一种,X的原子核里有14个中子,2.7gX在氧气里燃烧时,质量增加2.4g,X的氢氧化物既能与氢氧化钠溶液反应,也能与盐酸反应,X的元素符号是 , 它位于元素周期表中位置: