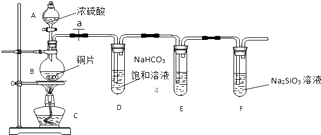
题目内容
【题目】有短周期元素A,B,C,D,E,
已知:①常温下,A元素的单质在空气或浓硫酸中,表面都能生成致密的氧化膜;
②B元素的原子序数比A元素大,其原子的次外层的电子数是最外层电子数的2倍;
③E与A同周期,C,D,E三种元素形成的单质或化合物可发生如图所示的反应.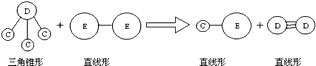
请回答下列问题:
(1)写出A元素最高价氧化物与NaOH溶液反应的离子方程式:;
(2)D元素的原子结构示意图是:;
(3)B元素与E元素的最高价氧化物的水化物的酸性强弱(用化学式表示):>;
(4)请用化学方程式表示E元素的单质在工业上的一种重要用途: .
【答案】
(1)Al2O3+2OH﹣═2AlO2﹣+H2O
(2)![]()
(3)HClO4;H2SiO3
(4)2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O
【解析】解:短周期元素A、B、C、D、E,①常温下,A元素的单质在空气或浓硫酸中,表面都能生成致密的氧化膜,则A为Al元素;②B元素的原子序数比A元素大,B处于第三周期,B原子的次外层的电子数是最外层电子数的2倍,最外层电子数为4,则B为Si元素;③E与A同周期,E的单质为双原子分子,通过单键形成,则E为Cl元素,D与C形成DC3 , 为三角锥型结构,D的单质通过三键形成的双原子分子,则D为氮元素、C为氢元素,(1)A元素最高价氧化物为Al2O3 , 与NaOH溶液反应的离子方程式为:Al2O3+2OH﹣═2AlO2﹣+H2O,所以答案是:Al2O3+2OH﹣═2AlO2﹣+H2O;(2)C为N元素,原子结构示意图为: ![]() ,所以答案是:
,所以答案是: ![]() ;处于元素周期表中第二周期第ⅤA族,所以答案是:二、ⅤA;(3)B元素与E元素的最高价氧化物的水化物分别为H2SiO3、HClO4 , 硅酸为弱酸,高氯酸为强酸,酸性:HClO4>H2SiO3 , 所以答案是:HClO4>H2SiO3;(4)氯气在工业上可以用于制备漂白粉等,反应方程式为:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O,所以答案是:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O.
;处于元素周期表中第二周期第ⅤA族,所以答案是:二、ⅤA;(3)B元素与E元素的最高价氧化物的水化物分别为H2SiO3、HClO4 , 硅酸为弱酸,高氯酸为强酸,酸性:HClO4>H2SiO3 , 所以答案是:HClO4>H2SiO3;(4)氯气在工业上可以用于制备漂白粉等,反应方程式为:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O,所以答案是:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O.

【题目】如表列出了A~R九种元素在周期表的位置:
主族 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | E | R | F | |||||
3 | A | C | D | H | I | G | ||
4 | B |
(1)写出R单质分子的电子式 .
(2)A、C、D三种元素的氧化物对应的水化物中碱性最强的是(填化学式).
(3)A,B,C三种元素的阳离子按离子半径由大到小的顺序排列为 . (用元素的离子符号表示).
(4)写出A的单质与水反应的离子方程式 .
(5)X元素是A~R九种元素中的一种,X的原子核里有14个中子,2.7gX在氧气里燃烧时,质量增加2.4g,X的氢氧化物既能与氢氧化钠溶液反应,也能与盐酸反应,X的元素符号是 , 它位于元素周期表中位置: