题目内容
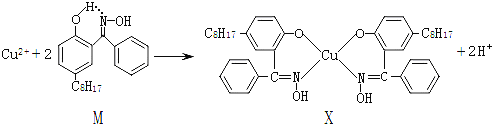
【题目】利用铜萃取剂M,通过如下反应实现铜离子的富集:
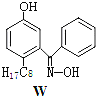
(1)关于M所含元素的说法正确的是______________。
A.电负性由大到小顺序:O>N>C>H
B.第一电离能由大到小的顺序:O>N>C
C.氮原子以sp2杂化轨道与氧原子形成σ键
D.从物质分类角度M属于芳香烃,M中所有的碳原子不可能共面
E.组成M元素的氢化物稳定性:CH4<H2O<NH3
(2)上述反应中断裂和生成的化学键有_______(填序号)。
A.氢键 B.配位键 C.金属键 D.范德华力 E.共价键 F.离子键
(3)M与W(分子结构如上图)相比,M的水溶性小,更利于Cu2+的萃取。M水溶性小的主要原因是_______________。
(4)基态Cu2+的外围电子排布图为________________,Cu2+等过渡元素水合离子是否有颜色与原子结构有关,且存在一定的规律。判断Sc3+、Zn2+的水合离子为无色的依据是_____________________________________________________________。
离子 | Sc3+ | Ti3+ | Fe2+ | Cu2+ | Zn2+ |
颜色 | 无色 | 紫红色 | 浅绿色 | 蓝色 | 无色 |
(5)已知:Y原子最高价氧化物对应水化物的酸性最强。铜与Y形成化合物的晶胞如附图所示(黑点代表铜原子,空心圆代表Y原子)。
①该晶体的化学式为_______________。(用元素符号表示)
②已知铜和Y原子的电负性分别为1.9和3.0,则铜与Y原子形成的化合物属于____________(填“离子”或“共价”)化合物。
③已知该晶体的密度为ρg·cm-3,阿伏加德罗常数为NA,则该晶体中铜原子与Y原子之间的最短距离为_______________pm(只写计算式)。
【答案】ACBEM能形成分子内氢键,使溶解度减小![]() 3d轨道上没有未成对电子(3d轨道上电子为全空或全满)CuCl共价
3d轨道上没有未成对电子(3d轨道上电子为全空或全满)CuCl共价![]() ×
×![]() ×1010或
×1010或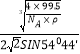 ×1010或
×1010或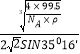 ×1010
×1010
【解析】
(1)M所含元素为C、H、O、N;
A.元素的非金属性越强,电负性越强;即同周期自左而右电负性增大;同一主族元素从上到下电负性逐渐减小;
B.同周期元素从左到右元素的第一电离能逐渐减小,则C元素的最小,由于N的2p轨道电子为半充满状态,难以失去电子,第一电离能大于O;
C.由结构简式可知N原子共形成3对共价键,1个配位键,即N原子采取sp2杂化;
D.芳香烃是含有苯环的烃,只含碳氢两种元素;
E.元素的非金属性越强,氢化物越稳定,以此解答。
(2)酚羟基中O-H间断裂,铜离子与O原子、N原子之间形成配位键,据此解答即可;
(3)分子内氢键的存在,导致水溶性减小,据此解答即可;
(4)根据核外电子排布规律书写Cu原子的核外电子排布式,电子按能层高低进行失去,进而书写Cu2+的外围电子排布图;判断Sc3+、Zn2+离子的原子核外3d轨道上是否含有电子来判断是否有颜色;
(5)①Y原子最高价氧化物对应水化物的酸性最强,可知Y是氯元素(Cl),该晶胞中铜原子个数=4,Cl原子个数=8× 1/8 +6× 1/2=4;
②电负性差大于1.7的键一般是离子键,小于1.7的一般为共价键,据此判断;
③Cu原子与周围的4个Cl原子形成正四面体结构,正四面体体心的Cu与晶胞顶点Cl原子距离最短,它们的连线处于晶胞体对角线上,且为晶胞体对角线长度的 1/4 ,根据晶胞含有原子数目计算晶胞质量,结合密度计算晶胞体积,进而计算晶胞棱长,晶胞体对角线长度为棱长的 ![]() 倍。
倍。
(1)A.元素的非金属性越强,电负性越强;即同周期自左而右电负性增大;同一主族元素从上到下电负性逐渐减小,故电负性由大到小顺序:O>N>C>H,A正确;
B.同周期元素从左到右元素的第一电离能逐渐减小,则C元素的最小,由于N的2p轨道电子为半充满状态,难以失去电子,第一电离能大于O,所以第一电离能从大到小的顺序为:N>O>C,B错误;
C.由结构简式可知N原子共形成3对共价键,1个配位键,即N原子采取sp2杂化,故C正确;
D.芳香烃是含有苯环的烃,故M不属于芳香烃,D错误;
E.元素的非金属性越强,氢化物越稳定,则组成M元素的氢化物稳定性:CH4<NH3<H2O,故E错误;
因此,本题答案为:AC;
(2)M中酚羟基中O-H间断裂,铜离子与O原子、N原子之间形成配位键,
因此,本题答案为:BE;
(3)由于M能形成分子内氢键,使溶解度减小,
因此,本题答案为:M能形成分子内氢键,使溶解度减小;
(4)Cu原子的核外电子排布式为1s22s22p63s23p63d104s1,故基态Cu2+的外围电子排布图为![]() ,Zn2+离子的原子核外排布式为1s22s22p63s23p63d10,d轨道上有10个电子,故Zn2+无色,Sc3+离子的原子核外排布式为1s22s22p63s23p6,其d轨道上有0电子,处于全空,故没有颜色,
,Zn2+离子的原子核外排布式为1s22s22p63s23p63d10,d轨道上有10个电子,故Zn2+无色,Sc3+离子的原子核外排布式为1s22s22p63s23p6,其d轨道上有0电子,处于全空,故没有颜色,
因此,本题答案为:![]() ;3d轨道上没有未成对电子(3d轨道上电子为全空或全满);
;3d轨道上没有未成对电子(3d轨道上电子为全空或全满);
(5)Y原子最高价氧化物对应水化物的酸性最强,可知Y是氯元素(Cl)。
①该晶胞中铜原子个数=4,Cl原子个数=8× 1/8 +6× 1/2 =4,所以其化学式为CuCl;
②铜和的电负性相差3.01.9=1.1,电负性差大于1.7的键一般是离子键,小于1.7的一般为共价键,故Cu与Y形成的化合物属于共价化合物,故答案为:共价;
③四面体的中心原子与两个顶点形成的夹角为109°28′,设铜原子与Y原子之间的距离(即中心原子与顶点的距离)为x,立方体边长a,则四面体的边长为 ![]() a,则由余弦定理可得:(
a,则由余弦定理可得:(![]() a)2=x2+x2-2x2cos109°28′,x=
a)2=x2+x2-2x2cos109°28′,x=![]() ,由于cos2α=1-2sin2α,
,由于cos2α=1-2sin2α,
所以cos109°28′=1-sin254°44′,1-cos109°28′=sin254°44′,x=![]() ,
,
晶体体积为 zM/NAρ,z表示一个晶胞中含有的CuCl的数目,已知z=4,
a=![]() ×1010,x=
×1010,x=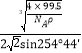 ×1010。
×1010。
由于sin54°44′=cos35°16′,x=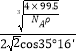 ×1010。
×1010。
四面体顶点到中心的距离与四面体边长的关系为x= ![]() a=
a=![]() a,故x=
a,故x=![]() ×
×![]() ×1010pm。
×1010pm。
因此,本题答案为:![]() ×
×![]() ×1010或
×1010或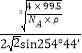 ×1010或
×1010或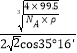 ×1010。
×1010。

 阅读快车系列答案
阅读快车系列答案