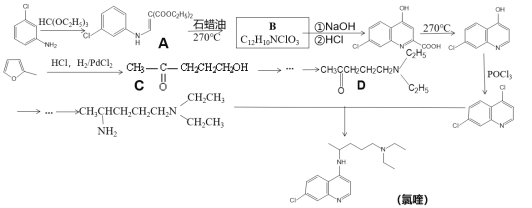
��Ŀ����
����Ŀ���ҹ���ѧ�ҳɹ��ϳ��˼������ӵ���ĸ��ѿ����ӻ�����(CH3NH3)PbI3������������нϸߵĹ��ת��Ч�ʶ���̫���ܵ�����������Ҫ��Ӧ�ü�ֵ���ش���������
��1��C��N��̬ԭ���У���һ�����ܽϴ����_____��
��2��CH3NH3+�ĵ���ʽΪ_____��C��Nԭ�ӵ��ӻ�������ͷֱ�Ϊ______��______��CH3NH3+�У�����______������ţ���
a������ b������ c����� d�����
��֪���Ĺ���������ǿ����ԭ�ӣ���CH3NH2��(CH3)2NH�н�������������ǿ����______��
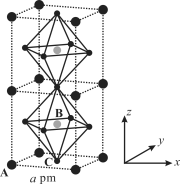
��3��(CH3NH3)PbI3����������ṹ��ͼ��ʾ������B����Pb2+����______���� I��ÿ�������к���I ����ĿΪ______��ԭ�ӷ�����������ڱ�ʾ�����ڲ���ԭ�ӵ����λ�á����У�ԭ�ӷ�������AΪ��0��0��0����BΪ��1/2��1/2��1/2������C��ԭ�ӷ�������Ϊ______����֪(CH3NH3)PbI3�ľ�������Ϊa pm�������ܶ�Ϊ g��cm3����NAΪ�����ӵ�������ֵ����(CH3NH3)PbI3��Ħ������Ϊ________g��mol1���ô���ʽ��ʾ����
���𰸡�N 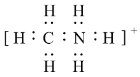 sp3 sp3 ac (CH3)2NH C 3 ��
sp3 sp3 ac (CH3)2NH C 3 ��![]() ��
��![]() ��0�� ��a3NA��10��30
��0�� ��a3NA��10��30
��������
��1��C��N�����ڵڶ����ڣ���һ��������������������N�ĵ�һ������ǿ��C���ʴ�Ϊ��N��
��2��CH3NH3+����ʽΪ��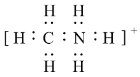 ��Cԭ�Ӻ���4�����������ӻ����Ϊsp3��Nԭ�Ӻ���4�����������ӻ����Ϊsp3�� ��CH3NH3+����ʽ��֪C��H��N��H֮�������������������N�ṩ�µ��Ӷԣ�H���пչ�������γ���λ�������Ĺ���������ǿ����ԭ�ӣ���CH3)2NH�к�����������������������ǿ���ʴ�Ϊ��
��Cԭ�Ӻ���4�����������ӻ����Ϊsp3��Nԭ�Ӻ���4�����������ӻ����Ϊsp3�� ��CH3NH3+����ʽ��֪C��H��N��H֮�������������������N�ṩ�µ��Ӷԣ�H���пչ�������γ���λ�������Ĺ���������ǿ����ԭ�ӣ���CH3)2NH�к�����������������������ǿ���ʴ�Ϊ��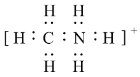 ��sp3��sp3��ac��(CH3)2NH��
��sp3��sp3��ac��(CH3)2NH��
��3��������A����ĿΪ![]() ��B����ĿΪ1��C����ĿΪ��
��B����ĿΪ1��C����ĿΪ��![]() ��B����Pb2+���ɻ�ѧʽ��֪(CH3NH3)PbI3 ��Pb2+��I����֮��Ϊ1:3����C����I������Ϊ3��ԭ�ӷ�������AΪ��0��0��0����BΪ��1/2��1/2��1/2������C��ԭ�ӷ�������Ϊ��
��B����Pb2+���ɻ�ѧʽ��֪(CH3NH3)PbI3 ��Pb2+��I����֮��Ϊ1:3����C����I������Ϊ3��ԭ�ӷ�������AΪ��0��0��0����BΪ��1/2��1/2��1/2������C��ԭ�ӷ�������Ϊ��![]() ��
��![]() ��0������������Ϊ
��0������������Ϊ![]() ���������Ϊ
���������Ϊ![]() �������ܶ�Ϊ
�������ܶ�Ϊ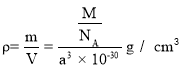 ����Ħ������Ϊ��a3NA��10��30���ʴ�Ϊ��C��3����
����Ħ������Ϊ��a3NA��10��30���ʴ�Ϊ��C��3����![]() ��
��![]() ��0������a3NA��10��30��
��0������a3NA��10��30��

 Ӣ��СӢ������Ĭдϵ�д�
Ӣ��СӢ������Ĭдϵ�д� �����ҵ���������ͯ������ϵ�д�
�����ҵ���������ͯ������ϵ�д�