题目内容
【题目】(1)下表中的数据表示破坏1 mol化学键需消耗的能量(即键能,单位为kJ·mol-1):
化学键 | C—H | C—F | H—F | F—F |
键能 | 414 | 489 | 565 | 158 |
根据键能数据计算以下反应的反应热△H: CH4(g)+4F2(g)= CF4(g)+4HF(g) △H=____。
(2)已知在448℃时,反应H2(g)+I2(g)![]() 2HI(g)的平衡常数K1为49,则反应HI(g)
2HI(g)的平衡常数K1为49,则反应HI(g)![]()
![]() H2(g)+
H2(g)+![]() I2(g)==的平衡常数K3为__________。
I2(g)==的平衡常数K3为__________。
(4)在一定条件下将CO2与H2混合转化为甲醇CH3OH是一种新型脱碳技术,这一反应同时生成H2O,实现了绿色环保、节能减排、废物利用等目的。在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2,进行上述反应。测得CO2和CH3OH(g)的物质的量浓度随时间的变化如图Ⅲ所示。

①该反应方程式为______________
②0~10 min内,氢气的平均反应速率为________;
③该温度下,反应的平衡常数为________(保留三位有效数字);
④10 min后,向该容器中再充入1 mol CO2和3 mol H2,则再次达到平衡时CH3OH(g)的体积分数________(填“增大”、“减小”或“不变”)。
【答案】1928kl/mol 1/7 CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) 0.225mol/(L·min) 5.33 增大
CH3OH(g)+H2O(g) 0.225mol/(L·min) 5.33 增大
【解析】
(1)化学反应的焓变=反应物总键能-生成物总键能。CH4(g)+4F2(g)=CF4(g)+4HF(g),△H=(414KJ/mol×4+158KJ/mol×4)-(489KJ/mol×4+565KJ/mol×4)=-1928KJ/mol,故答案为:-1928KJ/mol;
(2)反应H2(g)+I2(g)![]() 2HI(g)的平衡常数K1=c2(HI)/[c(H2)c(I2)]= 49
2HI(g)的平衡常数K1=c2(HI)/[c(H2)c(I2)]= 49
HI(g)![]()
![]() H2(g)+
H2(g)+![]() I2(g)==的平衡常数K3=
I2(g)==的平衡常数K3=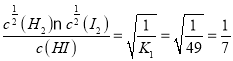 ,所以本题答案:
,所以本题答案:![]() ;
;
(3)①由图可知,CO2为反应物,CH3OH为生成物,由已知在一定条件下将CO2与H2混合转化为甲醇CH3OH同时生成H2O,10min时反应已经达平衡,△c(CO2)=1.00mol/L-0.25mol/L=0.75mol/L,△c(CH3OH)= 0.75mol/L,所以该反应的化学方程式为CO2(g)+3H2(g)![]() CH3OH(g)+ +H2O(g);答案:CO2(g)+3H2(g)
CH3OH(g)+ +H2O(g);答案:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g);
CH3OH(g)+H2O(g);
②10min内,v(CO2)= 0.75mol/L /10min =0.075mol/(L·min),反应速率之比等于计量数之比,v(H2)=3v(CO2)=3×0.075mol/(Lmin)=0.225mol/(Lmin);所以0~10 min内,氢气的平均反应速率为0.225mol/(Lmin);答案:0.225mol/(Lmin);
③开始CO2的浓度为1mol/L,故容器的体积为1mol/1molL=1L,H2的起始浓度为3mol/L=3mol/L,则
: CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g);
CH3OH(g)+H2O(g);
开始(mol/L) 1 3 0 0
变化(mol/L) 0.75 2.25 0.75 0.75
平衡(mol/L) 0.25 0.75 0.75 0.75
故该温度下平衡常数k= 0.75×0.75/[ 0.25×0.753]=5.33;
④第10min后,向该容器中再充入1molCO2和3molH2,等效为增大压强,平衡向正反应移动,CH3OH(g)的体积分数增大;答案:增大。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案



