题目内容
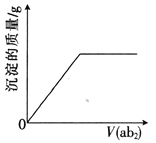
【题目】短周期主族元素a、b、c、d、e的原子序数依次增大,b是地壳中含量最高的元素,e的单质的熔点在同周期元素中最高,a、b的原子序数之和等于e的原子序数,d原子的核外电子层数等于最外层电子数:分别向cdb2溶液、c2eb3溶液中通入气体ab2,产生沉淀的质量与通入气体的体积的定性关系都可用右图表示。下列说法不正确的是
A. 原子半径:c>d>e>a>b
B. 工业上通常采用ab高温还原d2b3的方法冶炼d的单质
C. 同温下,0.1mol·L-1c2eb3溶液的pH大于0.1mol·L-1c2ab3溶液
D. 简单氢化物的热稳定性:b>a>e
【答案】B
【解析】短周期主族元素a、b、c、d、e的原子序数依次增大,b是地壳中含量最高的元素,为氧元素,e的单质的熔点在同周期元素中最高,为硅元素,a、b的原子序数之和等于e的原子序数,a为碳元素,d原子的核外电子层数等于最外层电子数,d为铝元素,分别向cdb2溶液即NaAlO2、c2eb3溶液Na2SiO3中通入气体ab2即CO2,产生沉淀的质量与通入气体的体积的定性关系符合图示关系。
A、同一周期原子半径从左到右逐渐减小,同一主族,原子半径从下到上逐渐减小,原子半径:c>d>e>a>b,故A正确;B、工业上通常采用电解法冶炼铝的单质,故B错误;C、碳酸的酸性大于硅酸,酸性越弱,对应的弱酸盐的水解能力越强,同温下,0.1mol·L-1Na2SiO3溶液的pH大于0.1mol·L-1Na2CO3溶液,故C正确;D、 简单氢化物的热稳定性:H2O>CH4>SiH4 即b>a>e,故D正确。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目