题目内容
【题目】到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.
(1)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关. 已知:H2(g)+Cl2(g)═2HCl(g)△H=﹣185kJ/mol
E(H﹣H)=436kJ/mol,E(Cl﹣Cl)=243kJ/mol
则E(H﹣Cl)= .
(2)纳米级Cu2O由于具有优良的催化性能而受到关注.已知: 2Cu(s)+ ![]() O2(g)═Cu2O(s)△H=﹣169kJmol﹣1 ,
O2(g)═Cu2O(s)△H=﹣169kJmol﹣1 ,
C(s)+ ![]() O2(g)═CO(g)△H=﹣110.5kJmol﹣1 ,
O2(g)═CO(g)△H=﹣110.5kJmol﹣1 ,
2Cu(s)+O2(g)═2CuO(s)△H=﹣314kJmol﹣1
则工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式为 .
(3)如图是N2和H2反应生成2mol NH3过程中能量变化示意图,请计算每生成1mol NH3放出热量为 . 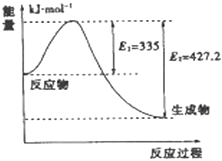
【答案】
(1)432kJ/mol
(2)C(s)+2CuO(s)=Cu2O(s)+CO(g)△H=+34.5KJ/mol
(3)46.1kJ
【解析】解:(1)反应热=反应物键能总和﹣生成物键能总和得到:436kJ/mol+243kJ/mol﹣2E(H﹣Cl)=﹣185kJ/mol,解得E(H﹣Cl)=432KJ/mol,
故答案为:432KJ/mol;(2)①2Cu(s)+ ![]() O2(g)═Cu2O(s)△H=﹣169kJmol﹣1,
O2(g)═Cu2O(s)△H=﹣169kJmol﹣1,
②C(s)+ ![]() O2(g)═CO(g)△H=﹣110.5kJmol﹣1,
O2(g)═CO(g)△H=﹣110.5kJmol﹣1,
③2Cu(s)+O2(g)═2CuO(s)△H=﹣314kJmol﹣1
依据盖斯定律②+①﹣③得到C(s)+2CuO(s)═Cu2O(s)+CO(g)△H=+34.5KJ/mol;
则工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式为C(s)+2CuO(s)═Cu2O(s)+CO(g)△H=+34.5KJ/mol,
故答案为:C(s)+2CuO(s)═Cu2O(s)+CO(g)△H=+34.5KJ/mol;(3)图象分析可知,N2和H2反应生成2mol NH3过程中能量变化示意图可知反应放热427.2KJ﹣335KJ=92.2KJ,每生成1mol NH3放出热量46.1KJ;
故答案为:46.1kJ.
(1)反应热=反应物总键能﹣生成物总键能,据此计算;(2)依据热化学方程式和盖斯定律计算得到所需热化学方程式;(3)分析图象N2和H2反应生成2mol NH3过程中能量变化示意图可知反应放热427.2KJ﹣335KJ=92.2KJ,每生成1mol NH3放出热量46.1KJ.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】在10 L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) ![]() M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | ||
n(X) | n(Y) | n(M) | |||
① | 700 | 0.40 | 0.10 | 0.090 | |
② | 800 | 0.10 | 0.40 | 0.080 | |
③ | 800 | 0.20 | 0.30 | a | |
④ | 900 | 0.10 | 0.15 | b | |
下列说法正确的是( )
A. 实验①中,若5 min时测得n(M)=0.050 mol,则0至5 min时间内,用N表示的平均反应速率v(N)=1.0×10-2 mol·L-1·min-1
B. 实验②中,该反应的平衡常数K=2.0
C. 实验③中,达到平衡时,X的转化率为60%
D. 实验④中,达到平衡时,b>0.060