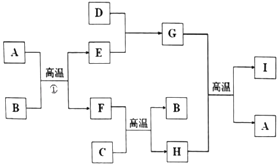
题目内容
【题目】铝及其合金在生活、生产中有广泛应用。
(1)最新研究表明:氢氧化铝溶于氢氧化钠溶液中生成Na[Al(OH)4]。则氢氧化铝在水中发生酸式电离的电离方程式为________________________________。
(2)目前,国内对真空碳热还原-氯化法冶炼铝的研究较多,利用该方法冶炼金属铝,既节能又环保。
已知:①Al2O3(s)+AlCl3(g)+3C(s)=====3AlCl(g)+3CO(g) △H1
②3AlCl(g)====2Al(l)+AlCl3(g) △H2
③Al(l)====Al(s) △H3
则Al2O3(s)+3C(s)====2Al(s)+3CO(g) △H4=___________(用含△H1、△H2、△H3的代数式表示)。
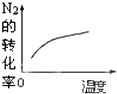
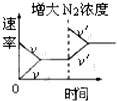
(3)已知:Al4C3是真空碳热还原-氯化法冶炼铝的中间产物,它与水反应生成气体Y,Y是含氢量最大的烃。向2L恒容密闭容器中充入2mol Y和2mol水蒸气,一定条件下发生反应a Y(g)+bH2O(g) ![]() c CO(g)+dH2(g) △H。测得Y的平衡转化率α(Y)与温度、压强的关系如图所示。
c CO(g)+dH2(g) △H。测得Y的平衡转化率α(Y)与温度、压强的关系如图所示。

①上述反应的△H_______0(填“>”“<”或“=”)。
②图象中,x_________0.1(填“>”“<”或“=”)。
③在T0K、0.1MPa时,上述反应的平衡常数K=____________。
④提高上述反应的反应速率的措施有_______________________________ (任填二项)。
⑤从上述反应体系中分离出H2(还含有少量CO)作为合成氨的原料气,为避免CO使催化剂中毒,原料气在通入合成塔之前需与适量NH3混合,并用[Cu(NH3)2]Ac溶液吸收CO,反应原理为[Cu(NH3)2]Ac(aq)+CO(g)+NH3(g) ![]() [Cu(NH3)3]Ac·CO(aq) △H<0。若从温度、压强两方面考虑,用[Cu(NH3)2]Ac溶液吸收CO的适宜条件是________________________。
[Cu(NH3)3]Ac·CO(aq) △H<0。若从温度、压强两方面考虑,用[Cu(NH3)2]Ac溶液吸收CO的适宜条件是________________________。
(4)我国首创的海水电池以铝板为负极,以接触空气的铁铂合金网为正极,以弱碱性的海水为电解质溶液,电池总反应为4Al+3O2+6H2O===4Al(OH)3。试写出海水电池的正极反应式:________。
【答案】 Al(OH)3+H2O![]() [Al(OH)4]+H ΔH1+ΔH2+2ΔH3 > < 6.75 mol2·L2 使用催化剂、增大反应物浓度、升高温度 低温、高压 O2+4e+2H2O===4OH
[Al(OH)4]+H ΔH1+ΔH2+2ΔH3 > < 6.75 mol2·L2 使用催化剂、增大反应物浓度、升高温度 低温、高压 O2+4e+2H2O===4OH
【解析】(1)氢氧化铝在水中发生酸式电离的电离方程式为 Al(OH)3+H2O![]() [Al(OH)4]+H ;(2)①Al2O3(s)+AlCl3(g)+3C(s)=====3AlCl(g)+3CO(g) △H1,②3AlCl(g)====2Al(l)+AlCl3(g) △H2,③Al(l)====Al(s) △H3,由盖斯定律,①+②+2③,则Al2O3(s)+3C(s)====2Al(s)+3CO(g) △H4=ΔH1+ΔH2+2ΔH3 ;(3)Al4C3是真空碳热还原-氯化法冶炼铝的中间产物,它与水反应生成气体Y,Y是含氢量最大的烃。Y为CH4①由图可知:升高温度,平衡转化率α(Y)增大,a Y(g)+bH2O(g)
[Al(OH)4]+H ;(2)①Al2O3(s)+AlCl3(g)+3C(s)=====3AlCl(g)+3CO(g) △H1,②3AlCl(g)====2Al(l)+AlCl3(g) △H2,③Al(l)====Al(s) △H3,由盖斯定律,①+②+2③,则Al2O3(s)+3C(s)====2Al(s)+3CO(g) △H4=ΔH1+ΔH2+2ΔH3 ;(3)Al4C3是真空碳热还原-氯化法冶炼铝的中间产物,它与水反应生成气体Y,Y是含氢量最大的烃。Y为CH4①由图可知:升高温度,平衡转化率α(Y)增大,a Y(g)+bH2O(g) ![]() c CO(g)+dH2(g),平衡正向移动,上述反应的△H>0;②向2L恒容密闭容器中充入2mol Y和2mol水蒸气,一定条件下发生反应a Y(g)+bH2O(g)
c CO(g)+dH2(g),平衡正向移动,上述反应的△H>0;②向2L恒容密闭容器中充入2mol Y和2mol水蒸气,一定条件下发生反应a Y(g)+bH2O(g) ![]() c CO(g)+dH2(g) ,该反应为 CH4(g)+1H2O(g)
c CO(g)+dH2(g) ,该反应为 CH4(g)+1H2O(g) ![]() 1CO(g)+3H2(g) ,由图平衡转化率α(Y)增大,平衡正向移动,再根据方程式的计量数,平衡向正向移动,应是减小压强,故图象中,x<0.1;
1CO(g)+3H2(g) ,由图平衡转化率α(Y)增大,平衡正向移动,再根据方程式的计量数,平衡向正向移动,应是减小压强,故图象中,x<0.1;
③在T0K、0.1MPa时,平衡转化率α(Y)=0.5时
CH4(g)+1H2O(g) ![]() 1CO(g)+3H2(g)
1CO(g)+3H2(g)
c始 1 1
c变 0.5 0.5 0.5 1.5
c平 0.5 0.5 0.5 1.5
上述反应的平衡常数K=![]() =6.75 mol2·L2。
=6.75 mol2·L2。
④提高上述反应的反应速率的措施有使用催化剂、增大反应物浓度、升高温度等(任填二项)。⑤[Cu(NH3)2]Ac(aq)+CO(g)+NH3(g) ![]() [Cu(NH3)3]Ac·CO(aq) △H<0。若从温度、压强两方面考虑,用[Cu(NH3)2]Ac溶液吸收CO的适宜条件是:低温和高压,低温和高压条件下,气体溶解度大。(4)氧气在正极得电子,被还原,海水电池的正极反应式: O2+4e+2H2O===4OH。
[Cu(NH3)3]Ac·CO(aq) △H<0。若从温度、压强两方面考虑,用[Cu(NH3)2]Ac溶液吸收CO的适宜条件是:低温和高压,低温和高压条件下,气体溶解度大。(4)氧气在正极得电子,被还原,海水电池的正极反应式: O2+4e+2H2O===4OH。

 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案【题目】煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝,回答下列问题:
(1)NaClO2中氯元素的化合价为______________。
(2)在鼓泡反应器中通入含有SO2和NOx的烟气,反应温度为323 K,NaClO2溶液浓度为5×103mol/L,溶液呈碱性。反应一段时间后溶液中离子浓度的分析结果如下表
离子 | SO42 | SO32 | NO3 | NO2 | Cl |
c/(mol/L) | 8.35×104 | 6.87×106 | 1.5×104 | 1.2×105 | 3.4×103 |
①以NO转化为NO3-为例,写出NaClO2溶液脱硝过程中主要反应的离子方程式__________。增加压强,NO的转化率__________(填“提高”“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐___________(填“提高”“不变”或“降低”)。
③由实验结果可知,脱硫反应速率脱硝反应速率__________(填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是________________________________。
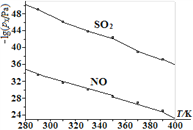
(3)在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压px如图所示。已知图中: ![]() 其中(nx代表各成分的物质的量,na代表气体总物质的量)
其中(nx代表各成分的物质的量,na代表气体总物质的量)
①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均____(填“增大”“不变”或“减小”)。
②反应ClO2+2SO32==2SO42+Cl的平衡常数K表达式为______________。
(4)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是______________________。
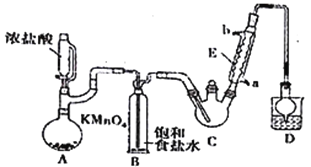
【题目】某探究小组设计如右图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验。查阅资料,有关信息如下:
①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
可能发生的副反应: C2H5OH+HCl→C2H5Cl+H2O;
CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl
②相关物质的部分物理性质:
C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
相对分子质量 | 46 | 147.5 | 163.5 | 64.5 |
熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇 三氯乙醛 | 微溶于水,可溶于乙醇 |
(1)仪器A中发生反应的化学方程式为_________________________________。
(2)装置B的作用是_________________。该实验在装置中有一处缺陷,即缺少氯气的干燥裝置,缺少该装置可能导致装置C 中副产物______________(填化学式)的量增加;冷凝管的进水口是________(填“a”或“b”);
(3)装置中球形冷凝管的作用是______________________,写出D中所有可能发生的无机反应的离子方程式___________________________________。
(4)反应结束后,从C中的混合物中分离出CCl3COOH的方法是_________________________。
(5)测定产品纯度:称取产品0.50g配成待测溶液,加0.1000 molL-1碘标准溶液20.00 mL,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,立即用0.02000 molL-1Na2S2O3溶液滴定至终点。进行三次平行实验,测得消耗Na2S2O3溶液20.00mL。则产品的纯度为_____________;(计算结果保留两位有效数字)滴定的反应原理:CCl3CHO+OH-==CHCl3span>+HCOO- HCOO-+I2== H++2I-+CO2↑ I2+2S2O32-==2I-+ S4O62-
(6)为证明三氯乙酸的酸性比乙酸强。某学习小组的同学设计了以下三种方案,你认为能够达到实验目的的是___________。
a.分别测定0.1mol·L-1两种酸溶液的pH,三氯乙酸的pH 较小
b.用仪器测量浓度均为0.1mol·L-1 的三氯乙酸和乙酸溶液的导电性,测得乙酸溶液的导电性弱
c.测定等物质的量浓度的两种酸的钠盐溶液的pH,乙酸钠溶液的pH 较大