题目内容
【题目】如图是短周期周期表的一部分①~⑨是元素周期表的部分元素。

请回答下列问题:
(1) ③、⑤、⑥对应的原子半径最大的是_____(写元素名称)
(2)元素⑤和⑧形成的化合物的电子式是_____,该化合物溶于水被破杯的化学键类型为_______。
(3)元素⑥和⑨的最高价氧化物对应的水化物发生反应的离子方程式是________。
(4)由表中两种元素形成的氢化物A和B都含有18个电子,A是一种6原子分子,可做火箭发动机燃料;B是一稗常见的氧化剂,已知液态A与液态B充分反应生成已知液态10电子分子和一种气态单质,写出A与B反应的化学方程式:______________。
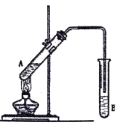
(5)某同学为了比较元素⑧和⑨非金属性的相对强弱,用如图所示装置进行实验:

①溶液c的作用是____________。
②溶液b是(填化学式)_____。写出溶液b中发生反应的离子方程式为_________。
【答案】 钠 ![]() 离子键 2H+ + Mg(OH)2=2H2O+Mg2+ N2H4+2H2O2= 4H2O+N2↑ 尾气处理,吸收氯气,防止污染 H2S或Na2S或NaHS Cl2+H2S=S↓+2H+ +2Cl-或Cl2+S2-=S↓+2Cl-或HS-+Cl2=2Cl-+H++S↓
离子键 2H+ + Mg(OH)2=2H2O+Mg2+ N2H4+2H2O2= 4H2O+N2↑ 尾气处理,吸收氯气,防止污染 H2S或Na2S或NaHS Cl2+H2S=S↓+2H+ +2Cl-或Cl2+S2-=S↓+2Cl-或HS-+Cl2=2Cl-+H++S↓
【解析】根据①~⑨元素在周期表中的位置可知分别是H、N、O、F、Na、Mg、Al、S、Cl。则
(1)同周期自左向右原子半径逐渐减小,同主族从上到下原子半径逐渐增大,则③、⑤、⑥对应的原子半径最大的是钠;
(2)元素⑤和⑧形成的化合物是离子化合物硫化钠,电子式为![]() ,该化合物溶于水电离出钠离子和硫离子,被破杯的化学键类型为离子键。
,该化合物溶于水电离出钠离子和硫离子,被破杯的化学键类型为离子键。
(3)元素⑥和⑨的最高价氧化物对应的水化物分别是氢氧化镁和高氯酸,发生反应的离子方程式是2H++Mg(OH)2=2H2O+Mg2+。
(4)由表中两种元素形成的氢化物A和B都含有18个电子,A是一种6原子分子,可做火箭发动机燃料,A是N2H4;B是一种常见的氧化剂,B是双氧水。已知液态A与液态B充分反应生成已知液态10电子分子和一种气态单质,即分别是水和氮气,反应的化学方程式为N2H4+2H2O2=4H2O+N2↑。
(5)要比较元素⑧和⑨非金属性的相对强弱,可以用氯气能置换出单质硫设计实验。则装置A中产生氯气,溶液b是H2S或Na2S或NaHS。
①由于氯气有毒,则溶液c是氢氧化钠溶液,作用是尾气处理,吸收氯气,防止污染空气。
②根据以上分析可知溶液b是H2S或Na2S或NaHS,其中发生反应的离子方程式为Cl2+H2S=S↓+2H++2Cl-或Cl2+S2-=S↓+2Cl-或HS-+Cl2=2Cl-+H++S↓。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案