题目内容
【题目】科学家研发出了一种新材料,其工作原理如图所示。在外接电源作用下,材料内部发生氧化还原反应导致颜色变化,从而实现对光的透过率进行可逆性调节。已知WO3和Li4Fe4[Fe(CN6]3均为无色透明,LiWO3和Fe4[Fe(CN6]3均有颜色。下列说法正确的是( )
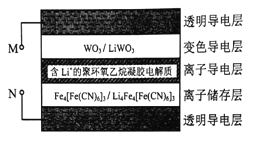
A. 当M外接电源正极时,该材料颜色变深使光的透过率降低
B. 该材料在使用较长时间后,离子导电层中Li+的量变小
C. 当M外接电源负极时,离子导电层中的Li+向变色导电层定向迁移
D. 当N外接电源正极时,离子储存层的电极反应式为:Fe4[Fe(CN6]3+4Li++4eˉ= Li4Fe4[Fe(CN6]3
【答案】C
【解析】A. 当M外接电源正极时,M为阳极,LiWO3失电子产生WO3,该材料颜色变浅使光的透过率增强,选项A错误;B. 电极总反应式为4WO3+Li4Fe4[Fe(CN6]3=4LiWO3+Fe4[Fe(CN6]3,该材料在使用较长时间后,离子导电层中L+的量不变,选项B错误;C. 当M外接电源负极时作为阴极,离子导电层中的阳离子Li+向阴极变色导电层定向迁移,选项C正确;D. 当N外接电源正极作为阳极时,离子储存层的电极反应式为Li4Fe4[Fe(CN6]3-4eˉ= Fe4[Fe(CN6]3+4Li+,选项D错误。答案选C。

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案【题目】已知 X、Y、Z、Q、R、E六种前四周期元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如表.
元素 | 结构或性质信息 |
X | 原子的L层上s电子数等于p电子数 |
Y | 原子核外的L层有3个未成对电子 |
Z | 地壳中含量最多的元素 |
Q | 单质常温常压下是气体,原子的M层上有1个未成对的p电子 |
R | 核电荷数是Y与Q的核电荷数之和 |
E | N能层上只有一个电子,K、L、M层均排满电子 |
请根据信息回答有关问题:
(1)写出元素Y的原子核外价电子排布图: . X的一种氢化物相对分子质量为26,其分子中的σ键与π键的键数之比为 .
(2)X、Y、Z三种元素的第一电离能由高到低的排列为(写元素符号) .
(3)X、Z元素分别与氢元素形成的最简单化合物中,沸点较高的为(写化学式) , 原因是 .
(4)XZ与Y2属于等电子体,写出化合物XZ的结构式: .
(5)R的一种配合物的化学式为RCl36H2O.已知0.01mol RCl36H2O在水溶液中用过量硝酸银溶液处理,产生0.02mol AgCl沉淀.此配合物最可能是 .
A.[R(H2O)6]Cl3
B.[R(H2O)5Cl]Cl2H2O
C.[R(H2O)4Cl2]Cl2H2O
D.[R(H2O)3Cl3]3H2O
(6)向含少量ESO4的水溶液中逐滴滴入氨水,生成蓝色沉淀,反应的离子方程式为: , 继续滴加氨水至过量,沉淀溶解, 得到天蓝色溶液,写反应的离子方程式为: .
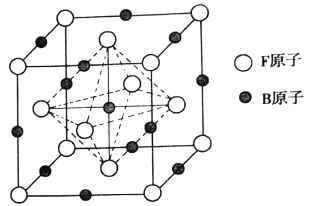
(7)元素E的单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示. 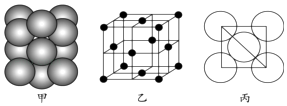
若已知该元素的原子半径为d cm,相对原子质量为M,NA代表阿伏加德罗常数,则该晶体的密度为gcm﹣3(用字母表示).