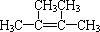题目内容
18.下列依据热化学方程式得出的结论正确的是( )| A. | 已知C(石墨,s)=C(金刚石,s);△H>0 则金刚石比石墨稳定 | |
| B. | 已知C(s)+O2(g)=CO2(g),△H1; C(s)+1/2O2(g)=CO(g),△H2; 则△H1>△H2 | |
| C. | 已知2H2(g)+O2(g)=2H2O(g);△H=-483.6kJ/mol 则氢气的燃烧热为241.8 kJ/mol | |
| D. | 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);△H=-57.3kJ/mol 则含20gNaOH的稀溶液与稀盐酸完全中和,放出28.65kJ的热量 |
分析 A、依据能量越高越活泼,能量越低越稳定来分析判断;
B、一氧化碳燃烧生成二氧化碳过程是放出热量,完全燃烧比不完全燃烧放出的热多;
C、燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量;
D、强酸和强碱反应生成1mol水放出的热量为中和热.
解答 解:A、已知C(石墨,s)=C(金刚石,s);△H>0,反应是吸热反应,金刚石能量高于石墨,所以金刚石不如石墨稳定,故A错误;
B、已知2C(s)+2O2(g)=2CO2(g)△H1,2C(s)+O2(g)=2CO(g)△H2,一氧化碳燃烧生成二氧化碳放热,焓变是负值,碳完全燃烧比不完全燃烧放出的热多,所以△H1<△H2,故B错误;
C、选项中生成的水是气体不是稳定氧化物,氢气的燃烧热不是241.8 kJ/mol,故C错误;
D、已知NaOH(ag)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.4 kJ/mol,则含20.0g NaOH物质的量为0.5mol的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,故D正确;
故选D.
点评 本题考查了热化学方程式的书写方法,燃烧热,中和热概念分析应用,掌握概念实质是关键,题目难度中等.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
13.下列说法不正确的是( )
| A. | 符合通式:CnH2n-2的有机物可能是炔烃还可能是二烯烃和环烯烃 | |
| B. | 乙烯既能使酸性KmnO4溶液褪色,又能使溴水褪色,其褪色的反应原理相同 | |
| C. | 某烃分子中只含一个苯环且侧链全是烷烃基,则该烃必是苯的同系物 | |
| D. | 2-丁炔分子中的四个碳原子一定在同一条直线上 |
3.不能作为判断硫、氯两种元素非金属性强弱的依据是( )
| A. | 单质氧化性的强弱 | |
| B. | 氢化物沸点的高低 | |
| C. | 氢化物还原性强弱 | |
| D. | 最高价氧化物对应的水化物酸性的强弱 |
 如图,A、B、C、D是中学常见的混合物分离或提纯的基本装置.实验室用四氯化碳浓缩碘水的碘,宜选用上述装置中的C(填A、B、C、D)
如图,A、B、C、D是中学常见的混合物分离或提纯的基本装置.实验室用四氯化碳浓缩碘水的碘,宜选用上述装置中的C(填A、B、C、D) 铁、铝及其化合物在生产和生活中有着广泛的应用.
铁、铝及其化合物在生产和生活中有着广泛的应用.