题目内容
7. 铁、铝及其化合物在生产和生活中有着广泛的应用.
铁、铝及其化合物在生产和生活中有着广泛的应用.(1)某研究性学习小组设计了如图所示装置探究钢铁的腐蚀与防护.
为防止金属Fe被腐蚀,可以采用上述②③(填装置序号)装置原理进行防护;装置③中总反应的离子方程式为2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH-.
(2)用CH4或其他有机物、O2为原料可设计成原电池,以CnH2nOn、O2为原料,H2SO4溶液为电解质设计成燃料电池,则负极的电极反应式为CnH2nOn-4ne-+nH2O=n CO2+4nH+.
(3)图1是在金属锌板上贴上一张用某溶液浸湿的滤纸,图2是NaBH4/H2O2燃料电池.

图2电池负极区的电极反应为BH4-+8OH--8e-═BO2-+6H2O;若用硫酸钠和酚酞的混合溶液浸湿滤纸,用导线将a、b直接相连,则滤纸出现红色,C位置的电极反应式为O2+2H2O+4e-═4OH-若用KI淀粉溶液浸湿滤纸,用导线将a、b与A、B电极相连,铅笔芯C点处出现蓝色,则b接的是B(填A或B)电极.
(4)广西治理龙江河镉(Cd2+)污染时,先向河中投入沉淀剂将Cd2+转化为难溶物,再投入氯化铝,试说明氯化铝的作用氯化铝溶于水,Al3+发生水解:Al3++3H2O?Al(OH)3+3H+,生成Al(OH)3胶体,能吸附镉的难溶物而发生聚沉(或沉降、沉淀或沉积下来),从而消除Cd2+污染
(用必要的离子方程式和文字进行解释).
分析 (1)①装置为原电池铁为负极被腐蚀;②装置为原电池锌做负极被腐蚀,铁做正极被保护;③装置为电解池,铁做阴极被保护;
(2)CnH2nOn的电极为负极,电极反应为:CnH2nOn-4ne-+nH2O=n CO2+4nH+;
(3)图2负极是BH4-发生氧化反应;原电池发生吸氧腐蚀,正极是氧气得电子生成大量的氢氧化钠,能使酚酞变红色;若用KI淀粉溶液浸湿滤纸,用导线将a、b与A、B电极相连,铅笔芯C点处出现蓝色,则阳极放电的是碘离子,为阳极与正极B相连;
(4)铝离子水解生成氢氧化铝胶体,胶体具有吸附作用能吸附杂质难溶物形成沉淀.
解答 解:(1))①装置为原电池铁为负极被腐蚀;②装置为原电池锌做负极被腐蚀,铁做正极被保护;③装置为电解池,铁做阴极被保护;②③装置中铁被保护,但装置③中发生的是电解饱和食盐水的反应,阳极是氯离子失电子生成氯气,阴极是氢离子得到电子发生还原反应,反应离子方程式为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH-,
故答案为:②③; 2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH-;
(2)通入CnH2nOn的电极为负极,电极反应为:CnH2nOn-4ne-+nH2O=n CO2+4nH+,故答案为:CnH2nOn-4ne-+nH2O=n CO2+4nH+;
(3)图2燃料电池的负极是BH4-发生氧化反应,电极反应式为BH4-+8OH--8e-═BO2-+6H2O,若用硫酸钠和酚酞的混合溶液浸湿滤纸,用导线将a、b直接相连,构成原电池,则锌电极为负极,锌失电子,铅笔芯为正极,氧气得电子,在该极生成大量的氢氧化钠,能使酚酞变红色;C位置的电极反应式为O2+2H2O+4e-═4OH-;若用KI淀粉溶液浸湿滤纸,用导线将a、b与A、B电极相连,铅笔芯C点处出现蓝色,则阳极放电的是碘离子,为阳极与正极B相连,
故选:BH4-+8OH--8e-═BO2-+6H2O;红;O2+2H2O+4e-═4OH-;B;
(4)污染时,先向河中投入沉淀剂将Cd2+转化为难溶物,再投入氯化铝,氯化铝水解生成氢氧化铝胶体具有吸附悬浮杂质的作用,可以把生成的难溶物吸附聚沉消除镉离子的 污染;
故答案为:氯化铝溶于水,Al3+发生水解:Al3++3H2O?Al(OH)3+3H+,生成Al(OH)3胶体,能吸附镉的难溶物而发生聚沉(或沉降、沉淀或沉积下来),从而消除Cd2+污染.
点评 本题考查了金属腐蚀与防护的方法和应用,原电池电极反应书写方法,电解池反应离子方程式的书写应用,重金属除杂方法的理解,题目难度中等.

| A. | x+y<z | B. | 平衡向正反应方向移动 | ||
| C. | B 的转化率增加 | D. | C 的体积分数下降 |
| A. | 已知C(石墨,s)=C(金刚石,s);△H>0 则金刚石比石墨稳定 | |
| B. | 已知C(s)+O2(g)=CO2(g),△H1; C(s)+1/2O2(g)=CO(g),△H2; 则△H1>△H2 | |
| C. | 已知2H2(g)+O2(g)=2H2O(g);△H=-483.6kJ/mol 则氢气的燃烧热为241.8 kJ/mol | |
| D. | 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);△H=-57.3kJ/mol 则含20gNaOH的稀溶液与稀盐酸完全中和,放出28.65kJ的热量 |
| A. |  | B. | 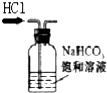 | C. | 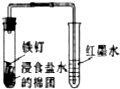 | D. |  |
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅰ | x≥a | 电极附近出现黄色,有气泡产生 | 有Fe3+、有Cl2 |
| Ⅱ | a>x≥b | 电极附近出现黄色,无气泡产生 | 有Fe3+、无Cl2 |
| Ⅲ | b>x>0 | 无明显变化 | 无Fe3+、无Cl2 |
(2)I中,Fe3+产生的原因可能是Cl-在阳极放电,生成的Cl2将Fe2+氧化.写出有关反应的方程式和电极反应式2Cl--2e-=Cl2↑,Cl2+2Fe2+=2Fe3++2Cl-.
(3)由II 推测,Fe3+产生的原因还可能是Fe2+在阳极放电,原因是Fe2+具有还原性.电极反应式为Fe2+-e-=Fe3+.
(4)II中虽未检测出Cl2,但Cl-在阳极是否放电仍需进一步验证.电解pH=1的NaCl溶液做对照实验,记录如下:
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅳ | a>x≥c | 无明显变化 | 有Cl2 |
| Ⅴ | c>x≥b | 无明显变化 | 无Cl2 |
②与II对比,可得出的结论:ABC
A.通过控制电压,验证了Fe2+先于Cl-放电
B.电压过小,Cl- 可能不放电
C.通过控制电压,证实了产生Fe3+的两种原因都成立
D.通过控制电压,证实了产生Fe3+一定仅是由于生成的Cl2将Fe2+氧化.
| A. | 锌是负极,氧化银是正极 | |
| B. | 锌发生氧化方应,氧化银发生还原反应 | |
| C. | 在电池放电过程中,电解质溶液的酸碱性基本保持不变 | |
| D. | 溶液中OH-向正极移动,K+、H+向负极移动 |
| A. | Al(OH)3胶体和AlCl3溶液本质区别为是否具有丁达尔效应 | |
| B. | 豆浆和雾都是胶体 | |
| C. | Fe(OH)3胶体能透过滤纸 | |
| D. | 向沸水中加入饱和FeCl3溶液,可制备Fe(OH)3胶体 |
 的叙述中不正确的是( )
的叙述中不正确的是( )| A. | 该物质遇FeCl3溶液显色 | |
| B. | 该物质可使溴水褪色 | |
| C. | 该物质与Na2CO3溶液反应放出CO2 | |
| D. | 该物质能发生水解反应,1 mol该有机物能2mo1的NaOH反应 |
| A. | 称量时,使用了游码,但砝码和药品放颠倒了 | |
| B. | 定容时俯视容量瓶刻度线 | |
| C. | 原容量瓶洗净后没有干燥 | |
| D. | 摇匀后见液面下降,再加水至刻度线 |