题目内容
16.分子式为N4的氮元素同素异形体,结构等同于白磷,N4中每个原子满足最外层8e-结构.则lmolN4中含有6NA对共用电子对.已知NH3、-NH2、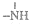 ,
,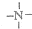 一定条件下都可以和H+结合.则N4和足量的H+反应生成的粒子的化学式为N4H44+.
一定条件下都可以和H+结合.则N4和足量的H+反应生成的粒子的化学式为N4H44+.
分析 白磷分子为正四面体,每个边都代表一个P-P键,所以共6个P-P共价键,据此推断即可;N4中每个原子满足最外层8e-结构,还含有1对孤对电子,每个N原子还能单独结合1个H离子,据此解答即可.
解答 解:白磷分子为正四面体,每个边都代表一个P-P键,所以共6个P-P共价键,N4的结构等同于白磷,故1molN4中含有6molN-N键,N4中每个原子满足最外层8e-结构,还含有1对孤对电子,每个N原子还能提供1个空轨道,结合1个H离子,故可以形成N4H44+,
故答案为:6NA;N4H44+.
点评 本题主要考查的是氮元素及其化合物,涉及氮的化合物的化学式、共价键等,考查的知识点较多,难度中等,侧重于考查学生对基础知识的综合应用能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
4.设NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 标准状况下,22.4LCCl4中含有的分子数目为NA | |
| B. | 7.8gNa2S和Na2O2的混合物中,含有的阴离子数目为0.1NA | |
| C. | 足量的铜与含有0.2molH2SO4的浓溶液共热可生成SO2为0.1NA | |
| D. | 标准状况下,2.24LCl2与足量的NaOH溶液反应,转移的电子数目为0.2NA |
11.二氧化硫的催化氧化是放热反应.下列关于接触法制硫酸的叙述中正确的是( )
| A. | 为防止催化剂中毒,炉气在进入接触室之前需要净化 | |
| B. | 为提高SO2的转化率,接触室内反应温度选定在400℃~500℃ | |
| C. | 为防止污染大气,从吸收塔出来的尾气常用NaOH溶液吸收 | |
| D. | 为提高SO3的吸收效率,用稀硫酸代替水吸收SO3 |
1.液氨溶解金钠属后成为蓝色的导电能力很强的溶液,其颜色被认为是电子的氨合e-(NH3)n引起的.若放置后,蓝色逐渐褪去,蒸发褪色后的溶液得到白色氨基钠(NaNH2),反应的化学方程式为:2Na+2NH3=NaNH2+H2↑,下列说法中不正确的是( )
| A. | 溶液褪色的速率与逸出氢气的速率成正比 | |
| B. | 液氨中有如下平衡:2NH3=NH4++NH2- | |
| C. | 液氨是一种非电解质,在水中才能电离 | |
| D. | 碱金属的液氨溶液是一种强还原剂 |
8.下列物质中,含有共价键的离子晶体是( )
| A. | KBr | B. | HCl | C. | I2 | D. | NaOH |
5.下列溶液中,跟100mL 0.5mol/L NaCl溶液所含的Cl-物质的量浓度相同的是( )
| A. | 100mL 0.5mol/L MgCl2溶液 | B. | 200mL 0.25mol/L CaCl2溶液 | ||
| C. | 50mL 1mol/L NaCl溶液 | D. | 250mL 0.2mol/L HCl溶液 |

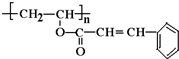
 ;
; 、
、 ,且苯环上有两个对位取代基的结构简式是
,且苯环上有两个对位取代基的结构简式是 .
.