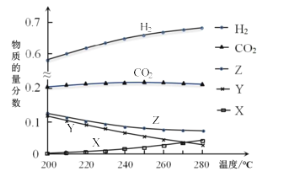
题目内容
【题目】铱(Ir)和锇(Os)属于铂族金属,与金、银合称贵重金属,可以用于电气、精密仪表、催化剂等领域。铱锇矿的主要成分有Ir、Os、Ir2O3、OsO2,还含有CuO和SiO2等杂质,从铱锇矿中提取铱(Ir)和锇(Os)的流程如下:
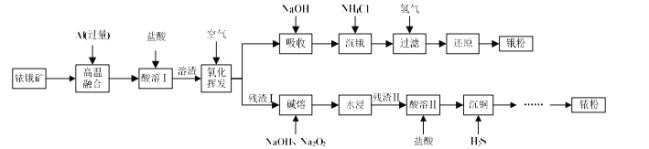
已知:①高温融合发生反应的原理类似于铝热反应。
②四氧化锇(OsO4)的熔点为41℃,易挥发、有恶臭和剧毒。
③四氨合二氧氯化锇([OsO2(NH3)4]Cl2)呈浅黄色,难溶于有机物,微溶于水,能水解。
回答下列问题:
(1)“酸溶I”的目的是_____________________________________;酸溶I后溶渣的主要成分除Ir、Os外,还有_______ (填化学式)。
(2)“氧化挥发”是将溶渣置于300~800 ℃的管式炉内,通入空气氧化。用NaOH溶液吸收OsO4生成Na2OsO4,该反应的离子方程式为 __________________;当吸收液质量增加59.5 g时,反应转移电子的数目为 ______。
(3)“沉锇”时, NH4Cl与Na2OsO4发生反应Na2OsO4 + 4NH4Cl=[OsO2(NH3)4]Cl2↓ + 2NaCl + 2H2O,该过程中NH4Cl需过量,目的是_____________________________ ;生成的锇盐要立即过滤,滤饼要经无水乙醇多次洗涤,用无水乙醇洗涤的原因是____。
(4)“残渣I”的主要成分为Ir、CuO和SiO2。“碱熔”时,Ir与Na2O2反应生成IrO2·nNa2O和O2,该反应的化学方程式为 _______________________。
(5) “沉铜” 过程中,当通入H2S 达到饱和时测得溶液的pH=1,此时溶液中c(Cu2+)为____。[已知:25 ℃下,H2S溶于水形成饱和溶液时,c(H2S)=0.1mol/L;H2S的电离常数![]() ,
,![]() ;
;![]() ]
]
【答案】溶解Al、溶解Al2O3与贵重金属分离 Cu、SiO2 2OsO4 + 4OH-=2OsO42-+ O2↑+ 2H2O 0.5NA 使锇元素完全转化为[OsO2(NH3)4]Cl2沉淀,提高回收率 减少[OsO2(NH3)4]Cl2的损耗,无水乙醇易挥发使固体迅速干燥,防止水解 2Ir+ 2nNa2O2![]() 2IrO2·nNa2O + (n-2)O2↑ 6×10-17 mol/L
2IrO2·nNa2O + (n-2)O2↑ 6×10-17 mol/L
【解析】
铱锇矿和过量Al高温融合,发生铝热反应后固体混合物的成分为Ir、Os、Cu、Al、Al2O3和SiO2;用盐酸完全溶解Al和氧化铝后过滤,所得溶渣为Ir、Os、Cu和SiO2,将溶渣在空气中高温氧化挥发,用NaOH溶液吸收OsO4得Na2OsO4溶液,向Na2OsO4溶液中加入过量NH4Cl达到沉锇目的,经过滤得[OsO2(NH3)4]Cl2,再经还原即可得到锇粉;同时氧化挥发后的残渣Ⅰ的主要成分为Ir、CuO和SiO2,用NaOH和Na2O2进行碱溶,其中Ir与Na2O2反应生成IrO2·nNa2O和O2,经水洗过滤后,浅渣Ⅱ为IrO2·nNa2O和CuO,用盐酸溶解IrO2·nNa2O和CuO后,向溶液中通入过量H2S气体,利用生成CuS达到沉铜的目的,最后经过滤后,滤液经系列操作可得铱粉,据此分析解题。
(1)“酸溶I”是用盐酸溶解固体混合物中的Al和Al2O3,达到与贵重金属铱和锇分离的目的;Ir、Os、Cu和SiO2均不溶于稀盐酸,则酸溶I后溶渣的主要成分除Ir、Os外,还有Cu、SiO2;
(2)用NaOH溶液吸收OsO4生成Na2OsO4,Os元素发生了还原反应,则反应中同时有O2生成,结合守恒法,可知发生反应的离子方程式为2OsO4 + 4OH-=2OsO42-+ O2↑+ 2H2O;由反应可知,每溶解2molOsO4生成1molO2,转移4mol电子,同时溶液增重质量为254g/mol×2mol-32g=476g,则当吸收液质量增加59.5g时,反应转移电子的数目为![]() ×4mol×NAmol-1=0.5NA;
×4mol×NAmol-1=0.5NA;
(3)“沉锇”时, 添加过量NH4Cl,促进反应完全进行,使锇元素完全转化为[OsO2(NH3)4]Cl2沉淀,提高回收率;[OsO2(NH3)4]Cl2)难溶于有机物,微溶于水,能水解,则洗涤时应选择无水乙醇,可减少[OsO2(NH3)4]Cl2的损耗,无水乙醇易挥发使固体迅速干燥,防止水解;
(4)碱熔时,Ir与Na2O2反应生成IrO2·nNa2O和O2,结合守恒法,发生反应的化学方程式为2Ir+ 2nNa2O2![]() 2IrO2·nNa2O + (n-2)O2↑;
2IrO2·nNa2O + (n-2)O2↑;
(5)已知H2SHS-+H+,HS-H++S2-,则Ka1×Ka2= ,H2S饱和时c(s2-)=
,H2S饱和时c(s2-)=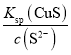 =
=![]() mol/L=6×10-17 mol/L。
mol/L=6×10-17 mol/L。