题目内容
【题目】锌及其化合物用途广泛。火法炼锌以闪锌矿(主要成分是ZnS)为主要原料,涉及的主要反应有:①2ZnS(s)+3O2(g)=2ZnO(s)+2SO2(g)△H1=﹣930kJmol-1
②2C(s)+O2(g)=2CO(g)△H2=﹣221kJmol-1
③ZnO(s)+CO(g)=Zn(g)+CO2(g)△H3=+198kJmol-1
(1)反应ZnS(s)+C(s)+2O2(g)=Zn(g)+CO2(g)+SO2(g)的△H4=____kJmol-1。
反应中生成的CO2与NH3混合,在一定条件下反应合成尿素:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g) △H。若该反应在一恒温、恒容密闭容器内进行,判断反应达到平衡状态的标志是___。
CO(NH2)2(s)+H2O(g) △H。若该反应在一恒温、恒容密闭容器内进行,判断反应达到平衡状态的标志是___。
a.CO2与H2O(g)浓度相等 b.容器中气体的压强不再改变
c.2v(NH3)正=v(H2O)逆 d.容器中混合气体的密度不再改变
(2)亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO与Cl2在一定条件下合成:2NO(g)+Cl2(g)![]() 2NOCl(g) △H<0。保持恒温恒容条件,将物质的量之和为3mol的NO和Cl2以不同的氮氯比[n(NO)/n(Cl2)]进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示:
2NOCl(g) △H<0。保持恒温恒容条件,将物质的量之和为3mol的NO和Cl2以不同的氮氯比[n(NO)/n(Cl2)]进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示:
①图中T1、T2的关系为:T1___T2(填“>”、“<”或“=”);
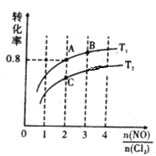
②图中纵坐标为物质___的转化率;
③图中A、B、C三点对应的NOCl体积分数最大的是____(填“A”、“B”、或“C”);
④若容器容积为2L,则B点的平衡常数的值为____。
【答案】﹣377.5 bd < Cl2 A 160
【解析】
(1)①2ZnS(s)+3O2(g)=2ZnO(s)+2SO2(g)△H1=-930kJmol-1
②2C(s)+O2(g)=2CO(g)△H2=-221kJmol-1
③ZnO(s)+CO(g)=Zn(g)+CO2(g)△H3=198kJmol-1
将方程式![]() +③得ZnS(s)+C(s)+2O2(g)=Zn(g)+CO2(g)+SO2(g),△H4=
+③得ZnS(s)+C(s)+2O2(g)=Zn(g)+CO2(g)+SO2(g),△H4=![]() +198kJ/mol=-377.5kJ/mol;
+198kJ/mol=-377.5kJ/mol;
a.CO2与H2O(g)浓度相等,正逆反应速率不一定相等,所以不一定达到平衡状态,故a错误;
b.该反应前后气体物质的量减少,当容器中气体的压强不再改变时正逆反应速率相等,反应达到平衡状态,故b正确;
c.当v(NH3)正=2v(H2O)逆时该反应达到平衡状态,所以当2v(NH3)正=v(H2O)逆时该反应没有达到平衡状态,故c错误;
d.反应前后气体密度改变,所以当容器中混合气体的密度不再改变时该反应达到平衡状态,故d正确;
(2)2NO(g)+Cl2(g)2NOCl(g)△H<0,反应为放热反应,升温平衡逆向进行,一定氮氯比条件下,升温平衡逆向进行,反应物平衡转化率减小,则T1<T2,
②保持恒温恒容条件,将物质的量之和为3mol的NO和Cl2以不同的氮氯比(![]() )进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示,
)进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示,![]() 越大,转化率越大,说明纵轴表示的是氯气的转化率,故答案为:Cl2;
越大,转化率越大,说明纵轴表示的是氯气的转化率,故答案为:Cl2;
③方程式中NO和Cl2的反应比为2:1,按照此反应比,氯气转化率最大时得到产物的体积分数最大,图中A、B、C三点对应的NOCl体积分数最大的是:A,故答案为:A;
④2NO(g)+Cl2(g)2NOCl(g)△H<0,保持恒温恒容条件,将物质的量之和为3mol的NO和Cl2以不同的氮氯比(![]() )进行反应,A点氯气转化率为0.8,
)进行反应,A点氯气转化率为0.8,![]() =2,体积为2L,结合三行计算列式计算,则
=2,体积为2L,结合三行计算列式计算,则
2NO(g)+Cl2(g)2NOCl(g)
起始量(mol/L) 1 0.5 0
变化量(mol/L) 0.8 0.4 0.8
平衡量(mol/L) 0.2 0.1 0.8
平衡常数K=![]() =160,故答案为:160。
=160,故答案为:160。