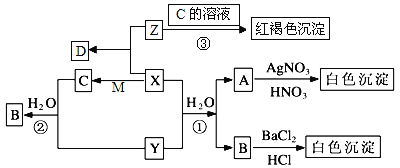
题目内容
【题目】将1molM和2 molN置于体积为2L的恒容密闭容器中,发生反应:M(s)+2N(g)![]() P(g)+Q(g) △H。反应过程中测得P的体积分数在不同温度下随时间的变化如图所示。下列说法正确的是( )
P(g)+Q(g) △H。反应过程中测得P的体积分数在不同温度下随时间的变化如图所示。下列说法正确的是( )

A. 若X、Y两点的平衡常数分别为K1、K2,则K1>K2
B. 温度为T1时,N的平衡转化率为80%,平衡常数K=40
C. 无论温度为T1还是T2,当容器中气体密度和压强不变时,反应达平衡状态
D. 降低温度、增大压强、及时分离出产物均有利于提高反应物的平衡转化率
【答案】A
【解析】
A. 若X点P的体积分数40%,Y点P的体积分数小于40%,X点P的含量高,P为生成物,产率越大,平衡常数越大,两点的平衡常数分别为K1、K2,则K1>K2,故A正确;
B. 温度为T1时,设N的变化量为xmol,根据反应:
M(s)+2N(g)![]() P(g)+Q(g)
P(g)+Q(g)
初始(mol):1 2 0 0
变化(mol): x ![]()
![]()
平衡(mol): 2-x ![]()
![]()
温度为T1时,X点P的体积分数=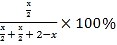 =40%,解得x=1.6mol。
=40%,解得x=1.6mol。
N的平衡转化率为=![]() =80%,平衡常数K=
=80%,平衡常数K=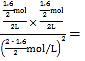 4,故B错误;
4,故B错误;
C. 该反应为反应前后气体体积不变的体系,压强不影响平衡移动,不能做为达到平衡的判断依据,故C错误;
D.该反应为反应前后气体体积不变的体系,增大压强,反应速率加快,但压强不影响平衡移动,转化率不变;根据“先拐先平数值大”的原则,T2> T1,降低温度P的体积分数减少,反应向逆向进行,即放热的方向进行,反应物的转化率较低,故D错误;
答案选A。

 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案【题目】固氮作用有3种途径:生物固氮、人工固氮和大气固氮。如表列举了不同温度下大气固氮的部分平衡常数K值。![]() 时,向
时,向![]() 的恒容密闭容器中充入
的恒容密闭容器中充入![]() 和
和![]() ,10s时反应达到平衡。
,10s时反应达到平衡。
反应 | 大气固氮 | |
温度/℃ | 27 | 2260 |
K |
| 1 |
下列说法正确的是( )
A.大气固氮反应属于放热反应
B.10 s末,![]() 的转化率约为
的转化率约为![]()
C.10 s内,用![]() 表示的平均反应速率为
表示的平均反应速率为![]()
D.10 s末,再向容器中充入![]() mol
mol ![]() 和
和![]() mol
mol ![]() ,
,![]() 的平衡转化率不变
的平衡转化率不变
【题目】一定温度下,10mL 0.40 mol·L-1H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 3 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是( )(溶液体积变化忽略不计)
A. 反应至6min时,H2O2分解了50%
B. 反应至6min时,c(H2O2)=0.20 mol·L-1
C. 0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol/(L·min)
D. 4~6min的平均反应速率:v(H2O2)>3.3×10-2mol/(L·min)