题目内容
【题目】下表标出的是元素周期表的一部分元素,回答下列问题:

(1)除稀有气体外第三周期中原子半径最小的是_____(填元素符号)
(2)表中用字母标出的12种元素中,化学性质最不活泼的是_____(用元素符号表示,下同),金属性最强的是___(用元素符号表示),属于过渡元素的是___(该空格用表中的字母表示)
(3)元素B的单质含有的化学键为_____。(填“离子键’’、“极性共价键”、“非极性共价键”)
(4)D、F元素最高价氧化物对应水化物相互反应的离子方程式为_____________
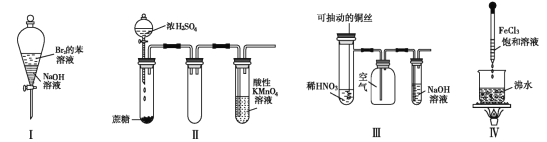
(5)为比较元素A和G的非金属性强弱,用图所示装置进行实验(夹持仪器已略去,装置气密性良好)。溶液B应该选用_____溶液,作用是_________,能说明A和G非金属性强弱的化学方程式是:________________________。

【答案】Cl Ar Na M 非极性共价键 Al(OH)3+OH﹣═AlO2﹣+2H2O 饱和NaHCO3 除去CO2中的HCl杂质 CO2+H2O+Na2SiO3=Na2CO3+H2SiO3↓
【解析】
本题截取元素周期表的片段,可根据位置推断出A为C,B为O,C为F,D为Na,E为Mg,F为Al,G为Si,H为P,I为S,J为Cl,K为Ar,M为过渡元素。
(1)同周期时,自左往右,原子半径越来越小,因而第三周期中的J、即Cl原子半径最小(除稀有气体);
(2)由于稀有气体原子为稳定结构,化学性质最不活泼,表中用字母标出的12种元素中,化学性质最不活泼的是K,即Ar;同周期时,自左往右,金属性越来越弱,同主族时,自上而下,金属性越来越强,因而可推知D,即Na金属性最强;过渡元素介于ⅡA和ⅢA之间,可推知M为过渡元素;
(3)元素B的单质为O2,O原子最外层有6个电子,需得电子形成8电子稳定结构,因而O原子之间形成共价键,且形成共价键的原子是相同的,因而该化学键为非极性共价键;
(4)D、F元素最高价氧化物对应水化物分别是NaOH和Al(OH)3,NaOH和Al(OH)3生成偏铝酸钠和水,离子方程式为Al(OH)3+OH﹣═AlO2﹣+2H2O;
(5)盐酸和大理石反应生成二氧化碳,由于盐酸易挥发,CO2中含有HCl杂质,可用饱和NaHCO3溶液除去HCl,其反应方程式为NaHCO3+HCl=NaCl+CO2↑+H2O,因而溶液B为饱和NaHCO3溶液,作用是除去CO2中的HCl杂质,碳酸的酸性强于硅酸,因而可用碳酸和硅酸盐反应制得硅酸,又元素的最高价含氧酸酸性越强,则元素的非金属性越强,能说明A和G非金属性强弱的化学方程式是CO2+H2O+Na2SiO3=Na2CO3+H2SiO3↓。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】1 L某混合溶液,可能含有的离子如下表:
阳离子 | H+、K+、Mg2+、Al3+、NH4+、Fe2+、Fe3+ |
阴离子 | Cl-、Br-、I-、CO32-、AlO2- |
(1)向该溶液中逐滴加入cmol/L NaOH溶液,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示。则该溶液中一定含有的离子是______________。
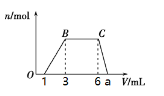
(2)根据图像数据计算a=_______________mL
(3)经检测,该溶液中还含有大量的Cl-、Br-、I-,若向1 L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,分析后回答下列问题:
Cl2的体积(标准状况) | 2.8 L | 5.6 L | 11.2 L |
n(Cl-) | 1.25 mol | 1.5 mol | 2 mol |
n(Br-) | 1.5 mol | 1.4 mol | 0.9 mol |
n(I-) | x mol(x≠0) | 0 | 0 |
①当通入Cl2的体积为5.6L时,溶液中发生反应的离子方程式为______________。
②原溶液中Cl-、Br-、I-的物质的量浓度之比为____________________________。
③x=_________________mol
【题目】将一铁、铜混合物粉末平均分成三等份,分别加入到同浓度、不同体积的稀硝酸中,充分反应后,收集到NO气体的体积及剩余固体的质量如表 (设反应前后溶液的体积不变,气体体积已换算为标准状况时的体积):
实验序号 | 稀硝酸的体积/mL | 剩余固体的质量/g | NO的体积/L |
1 | 100 | 17.2 | 2.24 |
2 | 200 | 8.00 | 4.48 |
3 | 400 | 0 | V |
下列说法正确的是( )
A. 表中V=7.84 L
B. 原混合物粉末的质量为25.6 g
C. 原混合物粉未中铁和铜的物质的量之比为2:3
D. 实验3所得溶液中硝酸的物质的量浓度为0.875 molL﹣1