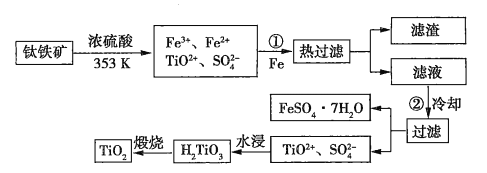
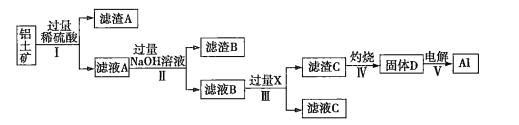
题目内容
【题目】![]() 和
和![]() 是两种重要的温室气体,通过
是两种重要的温室气体,通过![]() 和
和![]() 反应制造更高价值化学品是目前的研究目标。
反应制造更高价值化学品是目前的研究目标。
![]() 时,以镍合金为催化剂,向
时,以镍合金为催化剂,向![]() 容器中通入
容器中通入![]() 、
、![]() ,发生如下反应:
,发生如下反应:![]() 。平衡体系中各组分体积分数如下表:
。平衡体系中各组分体积分数如下表:
物质 |
|
| CO |
|
体积分数 |
|
|
|
|
![]() 此温度下该反应的平衡常数
此温度下该反应的平衡常数![]() __________
__________
![]() 已知:
已知:![]()
![]()
![]()
![]()
![]()
反应![]() 的
的![]() _____________
_____________![]()
![]() 以二氧化钛表面覆盖
以二氧化钛表面覆盖![]() 为催化剂,可以将
为催化剂,可以将![]() 和
和![]() 直接转化成乙酸。
直接转化成乙酸。
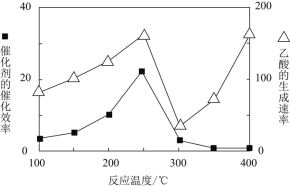
![]() 在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。
在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。![]() 时,温度升高而乙酸的生成速率降低的原因是___________。
时,温度升高而乙酸的生成速率降低的原因是___________。
![]() 为了提高该反应中
为了提高该反应中![]() 的转化率,可以采取的措施是_________。
的转化率,可以采取的措施是_________。
![]() 、
、![]() 、MgO均能吸收
、MgO均能吸收![]() ;
;
![]() 如果寻找吸收
如果寻找吸收![]() 的其他物质,下列建议不合理的是______
的其他物质,下列建议不合理的是______
![]() 可在具有强氧化性的物质中寻找
可在具有强氧化性的物质中寻找
![]() 可在碱性氧化物中寻找
可在碱性氧化物中寻找
![]() 可在ⅠA、ⅡA族元素形成的氧化物中寻找
可在ⅠA、ⅡA族元素形成的氧化物中寻找
![]() 吸收
吸收![]() 后,产物用于合成
后,产物用于合成![]() ,
,![]() 用于吸收、释放
用于吸收、释放![]() ,原理是:在
,原理是:在![]() ,
,![]() 与
与![]() 接触后生成
接触后生成![]() ;平衡后加热至
;平衡后加热至![]() ,反应逆向进行,放出
,反应逆向进行,放出![]() ,
,![]() 再生,说明该原理的化学方程式是_____________。
再生,说明该原理的化学方程式是_____________。
![]() 高温电解技术能高效实现下列反应:
高温电解技术能高效实现下列反应: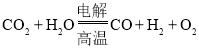 ,其可将释放的
,其可将释放的![]() 转化为具有工业利用价值的产品。工作原理示意图如下:
转化为具有工业利用价值的产品。工作原理示意图如下:
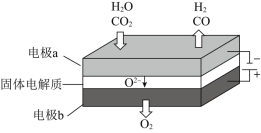
![]() 在电极a放电的电极反应式是____________。
在电极a放电的电极反应式是____________。
【答案】![]()
![]() 温度超过
温度超过![]() 时,催化剂的催化效率降低 增大反应压强或增大
时,催化剂的催化效率降低 增大反应压强或增大![]() 的浓度
的浓度 ![]()
![]() 4
4![]()
![]()
![]()
![]()
![]()
【解析】
(1)①先利用三段法求出各物质的物质的量,然后再根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积;
②根据盖斯定律来解答;
(2)①根据温度对催化剂活性的影响分析;
②提高该反应中CH4的转化率平衡正向移动,反应物转化率增大,根据外界条件对化学平衡的影响分析.
(3)在500℃,CO2与Li4SiO4接触后生成Li2CO3和另一种盐,该盐为Li2SiO3,据此书写反应原理方程式;
(4)根据图示信息:电极b氧离子失去电子,应该是发生氧化反应生成氧气,则b为阳极,与电源正极相连.
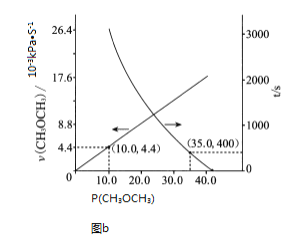
![]()
![]() .
.
起始![]() 6 0 0
6 0 0
反应![]() x 2x 2x
x 2x 2x
平衡![]()
![]() 2x 2x
2x 2x
由![]() 的体积分数为
的体积分数为![]() ,则
,则![]() ,解得
,解得![]() ,
,
![]() ;
;![]()
所以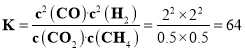 ;
;
![]() 已知:
已知:
![]()
![]()
![]() 根据盖斯定律,
根据盖斯定律,
由![]() 得,
得,![]() ;
;
![]() 温度超过
温度超过![]() 时,催化剂的催化效率降低,所以温度升高而乙酸的生成速率降低;
时,催化剂的催化效率降低,所以温度升高而乙酸的生成速率降低;
![]() 增大反应压强、增大
增大反应压强、增大![]() 的浓度,平衡正向移动,反应物转化率增大;
的浓度,平衡正向移动,反应物转化率增大;
![]() 、
、![]() 、MgO均能吸收
、MgO均能吸收![]() ,但它们都没有强氧化性,且吸收二氧化碳与氧化还原无关,故a不合理;
,但它们都没有强氧化性,且吸收二氧化碳与氧化还原无关,故a不合理;
![]() 、
、![]() 、MgO均属于碱性氧化物,均能吸收酸性氧化物
、MgO均属于碱性氧化物,均能吸收酸性氧化物![]() ,可在碱性氧化物中寻找吸收
,可在碱性氧化物中寻找吸收![]() 的其他物质,故b合理;
的其他物质,故b合理;
![]() 、
、![]() 、MgO均能吸收
、MgO均能吸收![]() ,锂、钠、镁为ⅠA、ⅡA族元素,所以可在A、ⅡA族元素形成的氧化物中寻找吸收
,锂、钠、镁为ⅠA、ⅡA族元素,所以可在A、ⅡA族元素形成的氧化物中寻找吸收![]() 的其他物质,故c合理;
的其他物质,故c合理;
![]() 在
在![]() ,
,![]() 与
与![]() 接触后生成
接触后生成![]() ,反应物为
,反应物为![]() 与
与![]() ,生成物有
,生成物有![]() ,根据质量守恒可知产物还有
,根据质量守恒可知产物还有![]() ,所以化学方程式为:
,所以化学方程式为:![]() 4
4![]()
![]() ;
;
![]() 二氧化碳在a极得到电子发生还原反应生成一氧化碳同时生成氧离子,反应电极反应式为:
二氧化碳在a极得到电子发生还原反应生成一氧化碳同时生成氧离子,反应电极反应式为:![]() 。
。

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案【题目】下列有关实验操作、现象和解释或结论都正确的是( )
选项 | 实验操作 | 现象 | 解释或结论 |
A | 过量的Fe粉中加入HNO3,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
B | NO2球浸泡在冰水中 | 颜色变浅 | 生成N2O4的反应是吸热过程 |
C | Na2S2O3溶液与稀硫酸反应,改变反应的温度 | 只有浑浊产生,温度越高,出现浑浊时间越短 | 温度越高,反应速率越快 |
D | 向重铬酸钾稀溶液中滴加3-10滴浓硫酸 | 溶液橙色加深 | 加酸抑制Cr2O72-向CrO42-的转化 |
A.AB.BC.CD.D
【题目】碳、氮及其化合物在生产、生活中广泛存在。
(1)煤气化的化学方程式为:C(s)+H2O(g)==CO(g)+H2(g) H,该反应在高温下能自发进行,则H_____0(填“>”或“<”)。
(2)煤气化的产物可用于合成甲醇。已知,在刚性容器中,有关反应及其在不同温度下的化学平衡常数如下表所示。
相关化学反应方程式 | 平衡 常数 | 温度(0C) | ||
500 | 700 | 800 | ||
(a)2H2(g)+CO(g) | K1 | 2.5 | 0.34 | 0.15 |
(b)H2(g)+CO2(g) | K2 | 1.0 | 1.70 | 2.52 |
(c)3H2(g)+CO2(g) | K3 | |||
①H1、H2、H3的关系是_____________,H3______0 (填“>”或“<”)
②下列措施能使反应(c)的平衡体系中n(CH3OH):n(CO2)增大的是_______(填字母代号)。
A.将H2O (g)从体系中分离出去 B.充入He (g)
C.升高温度 D.充入1mol H2 (g)
③500℃时,测得反应(c)在某时刻H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度分別为1.0mol·L-1、0.20mol·L-1、0.50mol·L-1、0.40mol·L-1,则此时反应(c)________。
A.向正反应方向进行 B.向逆反应方向进行
C.处于平衡状态 D.无法判断反应状态
(3)CO2

(4)汽车尾气主要有害物质是CO和NO,提高其转化效率是重要的研究课题。在密闭容器中充入5.0 mol CO和4.0 mol NO,发生以下反应:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H = -746 kJ·mol-1平衡时,NO的转化率与温度、压强的关系如图所示。
N2(g)+2CO2(g) △H = -746 kJ·mol-1平衡时,NO的转化率与温度、压强的关系如图所示。

①温度:T1_____T2(填“<”或“>”),
② 某温度下,反应达到平衡状态P点时,此时的平衡常数Kp=________________________(只列计算式)。