题目内容
【题目】某烃A的相对分子质量为84。回答下列问题:
(1)物质的量相同,下列物质充分燃烧与A消耗氧气的量不相等的是(填序号)__。
A.C7H12O2 B.C6H14 C.C6H14O D.C7H14O3
(2)若烃A为链烃,分子中所有的碳原子在同一平面上,该分子的一氯取代物只有一种。则A的结构简式为___。
(3)若A的名称为2-乙基-1-丁烯,核磁共振氢谱显示链烃A有三组不同的峰,峰面积比为___。
(4)若A不能使溴水褪色,且其一氯代物只有一种,则A的结构简式为___。
【答案】B  3:2:1
3:2:1 ![]()
【解析】
烃A的相对分子质量为84,用“商余法”,烃A的分子式应为C6H12。
(1)A.C7H12O2可以看成是C6H12·CO2,等物质的量充分燃烧与A消耗氧气的量相等,故不符合题意;
B.C6H14可以看成是C6H12·H2,等物质的量充分燃烧与A消耗氧气的量不相等,故符合题意;
C.C6H14O可以看成是C6H12·H2O,等物质的量充分燃烧与A消耗氧气的量相等,故不符合题意;
D.C7H14O3可以看成是C6H12·CO2·H2O,等物质的量充分燃烧与A消耗氧气的量相等,故不符合题意;
故答案为:B;
(2)若烃A为链烃,分子中所有的碳原子在同一平面上,6个碳都在碳碳双键的平面上,该分子的一氯取代物只有一种,除碳碳双键外其余4个碳上氢是等效氢,则A的结构简式为 。故答案为:
。故答案为: ;
;
(3)若A的名称为2-乙基-1-丁烯,A为CH2=C(CH2CH3)CH2CH3,核磁共振氢谱显示链烃A有三组不同的峰,峰面积比为6:4:2=3:2:1。故答案为:3:2:1;
(4)若A不能使溴水褪色,说明分子中没有碳碳双键,属于环烷烃,且其一氯代物只有一种,说明结构对称,则A的结构简式为![]() 。故答案为:
。故答案为:![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】![]() 和
和![]() 是两种重要的温室气体,通过
是两种重要的温室气体,通过![]() 和
和![]() 反应制造更高价值化学品是目前的研究目标。
反应制造更高价值化学品是目前的研究目标。
![]() 时,以镍合金为催化剂,向
时,以镍合金为催化剂,向![]() 容器中通入
容器中通入![]() 、
、![]() ,发生如下反应:
,发生如下反应:![]() 。平衡体系中各组分体积分数如下表:
。平衡体系中各组分体积分数如下表:
物质 |
|
| CO |
|
体积分数 |
|
|
|
|
![]() 此温度下该反应的平衡常数
此温度下该反应的平衡常数![]() __________
__________
![]() 已知:
已知:![]()
![]()
![]()
![]()
![]()
反应![]() 的
的![]() _____________
_____________![]()
![]() 以二氧化钛表面覆盖
以二氧化钛表面覆盖![]() 为催化剂,可以将
为催化剂,可以将![]() 和
和![]() 直接转化成乙酸。
直接转化成乙酸。
![]() 在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。
在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。![]() 时,温度升高而乙酸的生成速率降低的原因是___________。
时,温度升高而乙酸的生成速率降低的原因是___________。
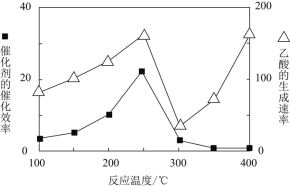
![]() 为了提高该反应中
为了提高该反应中![]() 的转化率,可以采取的措施是_________。
的转化率,可以采取的措施是_________。
![]() 、
、![]() 、MgO均能吸收
、MgO均能吸收![]() ;
;
![]() 如果寻找吸收
如果寻找吸收![]() 的其他物质,下列建议不合理的是______
的其他物质,下列建议不合理的是______
![]() 可在具有强氧化性的物质中寻找
可在具有强氧化性的物质中寻找
![]() 可在碱性氧化物中寻找
可在碱性氧化物中寻找
![]() 可在ⅠA、ⅡA族元素形成的氧化物中寻找
可在ⅠA、ⅡA族元素形成的氧化物中寻找
![]() 吸收
吸收![]() 后,产物用于合成
后,产物用于合成![]() ,
,![]() 用于吸收、释放
用于吸收、释放![]() ,原理是:在
,原理是:在![]() ,
,![]() 与
与![]() 接触后生成
接触后生成![]() ;平衡后加热至
;平衡后加热至![]() ,反应逆向进行,放出
,反应逆向进行,放出![]() ,
,![]() 再生,说明该原理的化学方程式是_____________。
再生,说明该原理的化学方程式是_____________。
![]() 高温电解技术能高效实现下列反应:
高温电解技术能高效实现下列反应: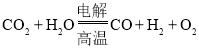 ,其可将释放的
,其可将释放的![]() 转化为具有工业利用价值的产品。工作原理示意图如下:
转化为具有工业利用价值的产品。工作原理示意图如下:
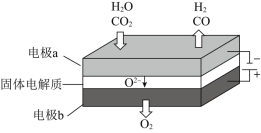
![]() 在电极a放电的电极反应式是____________。
在电极a放电的电极反应式是____________。
【题目】X、Y、Z、W四种元素的部分信息如下表所示。
元素 | X | Y | Z | W |
相关 信息 | 短周期元素,最高化合价为+7价 | 基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子 | 核外电子共有15种运动状态 | 能与X形成两种常见化合物WX2、WX3,酚遇WX3溶液能发生显色反应 |
回答下列问题:
(1)W的基态原子电子排布式为___,X、Y、Z三种元素电负性由大到小的顺序为___(用具体的元素符号填写)。
(2)化合物YX4、ZX3、ZX5(气态或液态时)中,中心原子的轨道类型不是sp3杂化的是___ (填化学式,下同),分子构型是正四面体的是___,ZX3属于___(极性分子、非极性分子)。
(3)已知WX3的熔点:306℃,沸点:319℃,则WX3的晶体类型为___。
(4)Z原子的价电子轨道表示式为___。
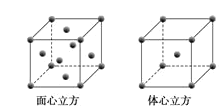
(5)W元素的单质晶体在不同温度下有两种堆积方式,晶胞分别如图所示。在面心立方晶胞中W原子的配位数为___;若W的原子半径为rcm,阿伏加德罗常数为NA,则其体心立方晶体的密度可表示为___gcm-3。