题目内容
【题目】乙烯是合成纤维、合成橡胶、合成塑料、合成乙醇![]() 酒精
酒精![]() 的基本化工原料,也用于制造氯乙烯、苯乙烯、环氧乙烷、醋酸、乙醛、乙醇和炸药等。世界上已将乙烯产量作为衡量一个国家石油化工发展水平的重要标志之一。工业上常采用烷烃裂解的方法制备乙烯。回答下列问题:
的基本化工原料,也用于制造氯乙烯、苯乙烯、环氧乙烷、醋酸、乙醛、乙醇和炸药等。世界上已将乙烯产量作为衡量一个国家石油化工发展水平的重要标志之一。工业上常采用烷烃裂解的方法制备乙烯。回答下列问题:
![]() 已知
已知![]() 、
、![]() 、
、![]() 的燃烧热分别为
的燃烧热分别为![]() 、
、![]() 、
、![]() 。利用乙烷制备乙烯的化学方程式
。利用乙烷制备乙烯的化学方程式![]()
![]() 。
。
![]() ________
________![]() 。
。
![]() 一定温度下,将
一定温度下,将![]() 加入固定体积的密闭容器中发生上述反应,下列能够表示到达平衡状态有________
加入固定体积的密闭容器中发生上述反应,下列能够表示到达平衡状态有________![]() 填字母
填字母![]() 。
。
A ![]()
![]() 气体压强不再变化
气体压强不再变化
C 气体的密度不再变化 D ![]() 的体积分数不再变化
的体积分数不再变化
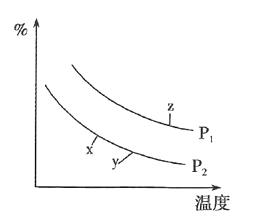
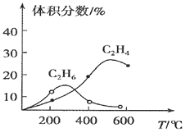
![]() 在某密闭容器中通入
在某密闭容器中通入![]() ,正丁烷
,正丁烷![]() ,在不同条件下发生反应
,在不同条件下发生反应![]() ,正丁烷
,正丁烷![]() ,测得平衡时
,测得平衡时![]() 的体积分数
的体积分数![]() 与温度、压强的关系如图所示。
与温度、压强的关系如图所示。
![]() ________
________![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() ,欲提高乙烯的产率,下列措施可行的是________。
,欲提高乙烯的产率,下列措施可行的是________。
A 加压升温 ![]() 加压降温
加压降温
C 减压降温 ![]() 减压升温
减压升温
E.选择优质催化剂
![]() 、y、z三点的化学平衡常数大小关系为________。
、y、z三点的化学平衡常数大小关系为________。
![]() 若z点对应的纵坐标的数值为50,此时
若z点对应的纵坐标的数值为50,此时![]() 的转化率为________,该条件下的化学平衡常数
的转化率为________,该条件下的化学平衡常数![]() ________
________![]() 用含有
用含有![]() 的表达式表示,
的表达式表示,![]() 为以分压表示的平衡常数
为以分压表示的平衡常数![]() 。
。
![]() 最近,中科院研究将甲烷在催化作用下脱氢后发生偶联反应生成乙烯,反应原理为:
最近,中科院研究将甲烷在催化作用下脱氢后发生偶联反应生成乙烯,反应原理为:![]() ,反应同时存在副反应:
,反应同时存在副反应:![]() ,实验测得产物的体积分数受温度影响变化如图所示,制取乙烯应控制的反应温度为________
,实验测得产物的体积分数受温度影响变化如图所示,制取乙烯应控制的反应温度为________![]() ,温度过高,乙烯的体积分数反而减少的主要原因是________。
,温度过高,乙烯的体积分数反而减少的主要原因是________。
【答案】![]()
![]()
![]() D
D ![]()
![]()
![]() 或
或![]()
![]() 温度升高,乙烯分解或发生其他副反应
温度升高,乙烯分解或发生其他副反应
【解析】
(1)![]() 分别写出燃烧热的化学方程式,得C2H6(g)C2H4(g)+H2(g)△H进行相应的改变;
分别写出燃烧热的化学方程式,得C2H6(g)C2H4(g)+H2(g)△H进行相应的改变;![]() 依据可逆反应处于平衡状态的判断方法分析;
依据可逆反应处于平衡状态的判断方法分析;
(2)![]() ,正丁烷
,正丁烷![]() ,正反应是体积增大的反应,出图像分析在压强不变的情况下升高温度,正丁烷的体积分数降低,根据勒夏特列原理分析;
,正反应是体积增大的反应,出图像分析在压强不变的情况下升高温度,正丁烷的体积分数降低,根据勒夏特列原理分析;
![]()
![]() 没有指明正逆反应,故A错误;
没有指明正逆反应,故A错误;
B.反应前后气体物质的量变化,气体压强不再变化说明反应达到平衡状态,故B正确;
C.定容条件下气体密度始终不变,故C错误;
D.![]() 的体积分数不再变化,可作为平衡状态的判定标志,故D正确;
的体积分数不再变化,可作为平衡状态的判定标志,故D正确;
![]() 反应为气体体积增大的反应,增大压强平衡逆向进行,丁烷体积分数增大,故
反应为气体体积增大的反应,增大压强平衡逆向进行,丁烷体积分数增大,故![]() ;
;
欲提高乙烯的产率,平衡应正向移动减压升温方法来实现,故选D;
平衡常数随温度变化,正反应为吸热反应,升温平衡正向进行,K增大,x、y、z三点的化学平衡常数大小关系为:![]() ,
,
![]() 若z点对应的纵坐标为50,说明丁烷的体积分数为
若z点对应的纵坐标为50,说明丁烷的体积分数为![]() ,
,
![]() ,正丁烷
,正丁烷![]()
起始量![]() 1 0 0
1 0 0
变化量![]() x x x
x x x
平衡量![]()
![]() x x
x x
![]()
![]() ,此时丁烷的转化率
,此时丁烷的转化率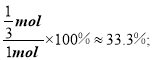
该条件下的化学平衡常数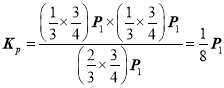 ;
;
![]() 从图像可以看出在
从图像可以看出在![]() 时乙烯的体积分数最高,因此制取乙烯应控制的反应温度为
时乙烯的体积分数最高,因此制取乙烯应控制的反应温度为![]() ,温度过高,乙烯的体积分数反而减少的主要原因是温度升高,乙烯分解或发生其他副反应。
,温度过高,乙烯的体积分数反而减少的主要原因是温度升高,乙烯分解或发生其他副反应。

 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案【题目】![]() 和
和![]() 是两种重要的温室气体,通过
是两种重要的温室气体,通过![]() 和
和![]() 反应制造更高价值化学品是目前的研究目标。
反应制造更高价值化学品是目前的研究目标。
![]() 时,以镍合金为催化剂,向
时,以镍合金为催化剂,向![]() 容器中通入
容器中通入![]() 、
、![]() ,发生如下反应:
,发生如下反应:![]() 。平衡体系中各组分体积分数如下表:
。平衡体系中各组分体积分数如下表:
物质 |
|
| CO |
|
体积分数 |
|
|
|
|
![]() 此温度下该反应的平衡常数
此温度下该反应的平衡常数![]() __________
__________
![]() 已知:
已知:![]()
![]()
![]()
![]()
![]()
反应![]() 的
的![]() _____________
_____________![]()
![]() 以二氧化钛表面覆盖
以二氧化钛表面覆盖![]() 为催化剂,可以将
为催化剂,可以将![]() 和
和![]() 直接转化成乙酸。
直接转化成乙酸。
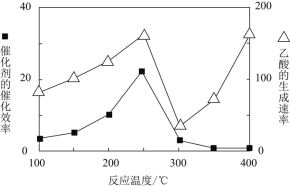
![]() 在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。
在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。![]() 时,温度升高而乙酸的生成速率降低的原因是___________。
时,温度升高而乙酸的生成速率降低的原因是___________。
![]() 为了提高该反应中
为了提高该反应中![]() 的转化率,可以采取的措施是_________。
的转化率,可以采取的措施是_________。
![]() 、
、![]() 、MgO均能吸收
、MgO均能吸收![]() ;
;
![]() 如果寻找吸收
如果寻找吸收![]() 的其他物质,下列建议不合理的是______
的其他物质,下列建议不合理的是______
![]() 可在具有强氧化性的物质中寻找
可在具有强氧化性的物质中寻找
![]() 可在碱性氧化物中寻找
可在碱性氧化物中寻找
![]() 可在ⅠA、ⅡA族元素形成的氧化物中寻找
可在ⅠA、ⅡA族元素形成的氧化物中寻找
![]() 吸收
吸收![]() 后,产物用于合成
后,产物用于合成![]() ,
,![]() 用于吸收、释放
用于吸收、释放![]() ,原理是:在
,原理是:在![]() ,
,![]() 与
与![]() 接触后生成
接触后生成![]() ;平衡后加热至
;平衡后加热至![]() ,反应逆向进行,放出
,反应逆向进行,放出![]() ,
,![]() 再生,说明该原理的化学方程式是_____________。
再生,说明该原理的化学方程式是_____________。
![]() 高温电解技术能高效实现下列反应:
高温电解技术能高效实现下列反应: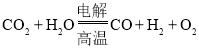 ,其可将释放的
,其可将释放的![]() 转化为具有工业利用价值的产品。工作原理示意图如下:
转化为具有工业利用价值的产品。工作原理示意图如下:
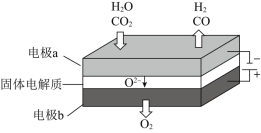
![]() 在电极a放电的电极反应式是____________。
在电极a放电的电极反应式是____________。
【题目】H2S在金属离子的鉴定分析、煤化工等领域都有重要应用。请回答:
Ⅰ.工业上一种制备H2S的方法是在催化剂、高温条件下,用天然气与SO2反应,同时生成两种能参与大气循环的氧化物。
(1)该反应的化学方程式为_____________。
Ⅱ.H2S可用于检测和沉淀金属阳离子。
(2)H2S的第一步电离方程式为________。
(3)已知:25 ℃时,Ksp(SnS)=1.0×10-25,Ksp(CdS)=8.0×10-27。该温度下,向浓度均为0.1 mol·L-1的CdCl2和SnCl2的混合溶液中通入H2S,当Sn2+开始沉淀时,溶液中c(Cd2+)=________(溶液体积变化忽略不计)。
Ⅲ.H2S是煤化工原料气脱硫过程的重要中间体。反应原理为
ⅰ.COS(g)+H2(g) ![]() H2S(g)+CO(g) ΔH=+7 kJ·mol-1;
H2S(g)+CO(g) ΔH=+7 kJ·mol-1;
ⅱ.CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH=-42 kJ·mol-1。
CO2(g)+H2(g) ΔH=-42 kJ·mol-1。
(4)已知:断裂1 mol分子中的化学键所需吸收的能量如表所示。
分子 | COS(g) | H2(g) | CO(g) | H2S(g) | H2O(g) | CO2(g) |
能量/(kJ·mol-1) | 1 319 | 442 | x | 678 | 930 | 1 606 |
表中x=________。
(5)向10 L容积不变的密闭容器中充入1 mol COS(g)、1 mol H2(g)和1 mol H2O(g),进行上述两个反应。其他条件不变时,体系内CO的平衡体积分数与温度(T)的关系如图所示。
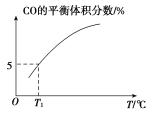
①随着温度升高,CO的平衡体积分数_____(填“增大”或“减小”)。原因为_______
②T1℃时,测得平衡时体系中COS的物质的量为0.80 mol。则该温度下,COS的平衡转化率为_____;反应ⅰ的平衡常数为_____(保留两位有效数字)。
【题目】用化学反应原理研究氮的氧化物和硫的氧化物有着重要的意义。
(1)已知:2SO2(g)+ O2(g)![]() 2SO3(g) △H1
2SO3(g) △H1
2NO(g)+ O2(g)![]() 2NO2 (g) △H2
2NO2 (g) △H2
NO2 (g) + SO2(g)![]() SO3(g) + NO(g) △H3
SO3(g) + NO(g) △H3
则△H3 =__________(用△H1、△H2表示),如果上述三个反应方程式的平衡常数分别为K1、 K2、K3,则K3 =__________(用K1、K2表示)。
(2)如图所示,A 是恒容的密闭容器,B 是一个体积可变的充气气囊。保持恒温,关闭K2,分别将2mol NO 和1 mol O2通过K1、K3分别充入A、B 中,发生的反应为2NO(g)+ O2(g)![]() 2NO2 (g) [不考虑2NO2 (g)
2NO2 (g) [不考虑2NO2 (g)![]() N2 O4 (g) ],起始时A、B 的体积相同均为a L。
N2 O4 (g) ],起始时A、B 的体积相同均为a L。
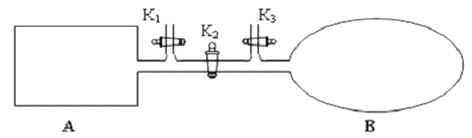
①下列说法和示意图正确,且既能说明A 容器中反应达到平衡状态,又能说明B 容器中反应达到平衡状态的是_________。
a. A、B 容器中气体的颜色均不再发生变化
b. A、B 容器中NO 和O2物质的量浓度比均为2:1

② T℃时,A 容器中反应达到平衡时的平衡常数Kp = 8×10﹣2 (kPa)﹣1。若A 容器中反应达到平衡时p(NO2) = 200kPa,则平衡时NO的转化率为_____________。(Kp 是用平衡分压代替平衡浓度计算所得平衡常数,分压=总压×物质的量分数)
(3)将0.2 mol SO2和0.15 mol O2通入2L 的密闭容器中,测得SO2的物质的量随时间变化如 图实线 所示。
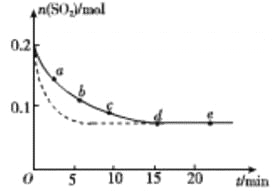
编号 | a | b | c | d | e |
n(SO2)/mol | 0.16 | 0.12 | 0.09 | 0.07 | 0.07 |
t/min | 2 | 5 | 8 | 15 | 22 |
①ab 段平均反应速率____________(填“大于”“小于”或“等于”)bc 段平均反应速率:de 段平均反应速率为_________________。
②仅改变某一个实验条件,测得SO2的物质的量随时间变化如图中虚线所示,则改变的条件是__________。