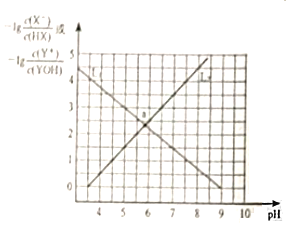
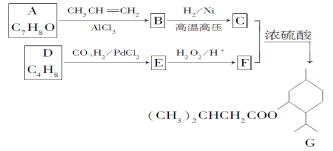
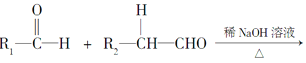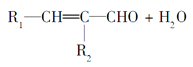题目内容
【题目】过氧化氢(H2O2)的水溶液俗称双氧水。双氧水常被称为化学反应中的“绿色试剂”。已知,在含少量I-的溶液中,H2O2会较快分解,反应如下:反应①:H2O2+I- → H2O+IO-; 反应②:H2O2+IO- → H2O+O2+I-,完成下列填空:
(1)反应①中的氧化产物是_________,被还原的元素是___________。
(2)标出反应②中电子转移的方向和数目。_______________
(3)H2O2分解过程中,I-的作用是__________。
(4)根据反应①和反应②,请说明双氧水被称为“绿色试剂”的主要原因是_____。
(5)H2O2是一种二元弱酸,写出第一步电离的电离方程式:________,双氧水可漂白纤维织物,目前认为是其中过氧化氢离子(HOO-)的作用。为了增强其漂白效果,应选择在____(填“酸”、“碱”或“中”)性条件下进行。
(6)向盐酸酸化的FeCl2溶液中加入双氧水,溶液由浅绿色变为棕黄色,写出该变化的化学反应方程式:_____________。
【答案】IO- 负一价的O ![]() 催化剂 H2O2的氧化产物是O2,还原产物是H2O,都不会污染环境 H2O2
催化剂 H2O2的氧化产物是O2,还原产物是H2O,都不会污染环境 H2O2![]() H++HO2- 碱 2FeCl2 + H2O2 + 2HCl → 2FeCl3 + 2H2O
H++HO2- 碱 2FeCl2 + H2O2 + 2HCl → 2FeCl3 + 2H2O
【解析】
H2O2中-1价的氧,既可得电子成-2价(H2O或OH-),生成表现较强的氧化性;也可失电子成0价(O2),表现还原性。总反应的催化剂在分步反应中,先作反应物、后作生成物。
(1)反应①中,I-→ IO-,碘元素失电子,IO-是氧化产物;H2O2→ H2O+IO-,氧元素得电子被还原。
(2)反应②中,H2O2→O2,氧元素失电子;IO-→ I-,碘元素得电子。电子转移的方向和数目可表示为![]() 。
。
(3)反应①与反应②相加,得H2O2分解反应2H2O2= 2H2O+O2↑。I-是①的反应物、②的生成物,故为总反应的催化剂。
(4)反应①中H2O2被还原成H2O,反应②中H2O2被氧化成O2,H2O、O2都不会污染环境。故双氧水被称为“绿色试剂”。
(5)H2O2是一种二元弱酸,则其电离分步且可逆,第一步电离方程式为H2O2![]() H++HO2-。双氧水可用于漂白,要增强其漂白效果,应提高过氧化氢离子(HOO-)的浓度。故选择在碱性条件,使电离平衡右移。
H++HO2-。双氧水可用于漂白,要增强其漂白效果,应提高过氧化氢离子(HOO-)的浓度。故选择在碱性条件,使电离平衡右移。
(6)向盐酸酸化的FeCl2溶液中加入双氧水,Fe2+(浅绿色)被氧化成Fe3+(棕黄色),化学方程式2FeCl2+H2O2+2HCl → 2FeCl3+2H2O。

【题目】通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一.对下列实验事实的解释不正确的是
现象 | 解释或结论 | |
A | SO2使酸性高锰酸钾溶液褪色 | SO2表现还原性 |
B | 铝片放入浓硫酸中,无明显变化 | 说明铝与冷的浓硫酸不发生化学反应 |
C | 某溶液中加入浓NaOH溶液加热,放出气体能使湿润的红色石蕊试纸变蓝 | 该溶液中一定含有NH |
D | 浓HNO3在光照条件下变黄 | 浓HNO3不稳定,生成有色产物能溶于浓硝酸 |
A.AB.BC.CD.D