题目内容
【题目】CO2是一种主要的温室气体,研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)金刚石和石墨燃烧反应中的能量变化如图所示。在通常状况下,金刚石和石墨中,__(填“金刚石”或“石墨”)更稳定,石墨的燃烧热ΔH为___。

(2)采用电化学法可将二氧化碳转化为甲烷,试写出以氢氧化钾水溶液作电解质溶液时,该转化的电极反应式为___。
(3)以CO2为原料还可以合成多种物质。工业上常以CO2(g)与H2(g)为原料合成乙醇。
①已知:H2O(l)=H2O(g) △H=+44kJ·mol-1
CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-41.2kJ·mol-1
CO2(g)+H2(g) △H=-41.2kJ·mol-1
2CO(g)+4H2(g)![]() CH3CH2OH(g)+H2O(g) △H=-256.1kJ·mol-1
CH3CH2OH(g)+H2O(g) △H=-256.1kJ·mol-1
则:CO2气体与氢气反应生成气态乙醇和液态水的热化学方程式为___。
②如图是一种以烟道气为原料合成乙醇的工作原理示意图。对该流程的分析,下列说法正确的是___。

A.该流程至少包含4种形式的能量转化
B.装置X中为了增强水的导电性,通常向其中加入少量Na2SO4或NaOH
C.合成塔中生成乙醇的反应是化合反应
D.流程设计体现了绿色化学思想
③如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。该电池负极的电极反应式为_____。

【答案】石墨 -393.5kJ/mol CO2+8e-+6H2O=CH4+8OH- 2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(l) △H=-305.7kJ/mol ABD CH3CH2OH-4e-+H2O=4H++CH3COOH
CH3CH2OH(g)+3H2O(l) △H=-305.7kJ/mol ABD CH3CH2OH-4e-+H2O=4H++CH3COOH
【解析】
根据图示能量转化关系及能量大小判断物质稳定性,并计算反应热;根据盖斯定律计算未知反应的反应热;根据图示的原电池装置判断电池正负极并写出电极方程式。
(1)根据图示可知,相同物质的量的金刚石、石墨燃烧,金刚石放热多,所以金刚石的能量大于石墨,金刚石和石墨中,石墨更稳定;石墨的燃烧热是1mol石墨完全燃烧生成二氧化碳放出的热量,根据图示,1mol石墨完全燃烧生成二氧化碳放出(110.5+283.0)=393.5 kJ,所以石墨燃烧的△H=-393.5kJ/mol;
(2)采用电化学法可将二氧化碳转化为甲烷,二氧化碳在正极得电子发生还原反应生成甲烷,该转化的电极反应式是CO2+8e-+6H2O=CH4+8OH-;
(3) ①根据盖斯定律,用第三个方程式减去3倍的第一个方程减去2倍的第二个方程式即得到目标方程式,2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(l)△H=-305.7 kJ/mol;
CH3CH2OH(g)+3H2O(l)△H=-305.7 kJ/mol;
②A选项,流程图中包括:光能→电能、电能→化学能,热能→化学能,化学能→化学能,热能→动能,故A正确;
B选项,电解过程中加入Na2SO4或NaOH有助于增强溶液导电性,同时在电解过程中也不产生其他影响产率的物质,B正确;
C选项,合成塔中的反应方程式为:6H2+2CO2=CH3CH2OH+3H2O,不是化合反应,故C错误;
D选项,产物是乙醇和水,无污染,故D正确;
故答案选ABD。
(4)利用该装置可以检测酒精含量,其总反应为CH3CH2OH+O2=CH3COOH+H2O,正极反应式为O2+4e-+4H+=2H2O,负极反应式为CH3CH2OH-4e-+H2O=4H++CH3COOH。

 阅读快车系列答案
阅读快车系列答案【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是
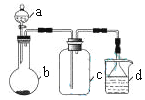
选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
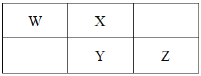
【题目】元素周期表中的四种元素的有关信息如下,请用合理的化学用语填写空白。
在周期表中的区域 | 元素代号 | 有关信息 |
短周期元素 | X | X的最高价氧化物的水化物甲是一种胃酸中和剂,且能溶于强碱溶液 |
Y | Y的一种氢化物可用于制造纯碱和做制冷剂 | |
长周期元素 | Z | Z的一种盐乙可以作净水剂,Z的某种氧化物丙可以做红色涂料 |
W | W元素大多存在于海藻种,它的银盐可用于人工降雨 |
(1)X元素周期表中的位置为___,X、Y、Z三种元素的简单离子半径从大到小的顺序为___。
(2)足量W的最高价氧化物的水化物是稀溶液与1mol甲完全反应,放出热量QkJ,请写出表示该过程中和热的热化学方程式:____。
(3)下列有关W的气态氢化物丁的说法正确的有___(选填字母)
a.丁比氯化氢沸点高 b.丁比氯化氢稳定性好
c.丁比氟化氢还原性弱 d.丁比氟化氢酸性弱
(4)请写出丙溶于丁的水溶液的离子方程式___。