题目内容
8.CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.已知:①CuCl可以由CuCl2用适当的还原剂如SO2、SnCl2等还原制得:
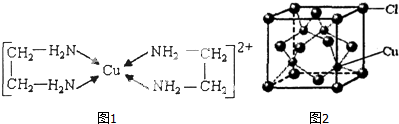
②CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配如图1离子.
请回答下列问题:
(1)基态Cu原子的核外电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1.
(2)SO2晶体的熔点比CuCl晶体低(填“高”或“低”),SO2分子的空间构型为V形.
(3)乙二胺分子中氮原子轨道的杂化类型为sp3杂化.乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高(填“高”或“低”),原因是乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键
(4)②中所形成的配离子中含有的化学键类型有abd.(填字母)
a.配位键 b.极性键 c.离子键 d.非极性键
(5)CuCl的晶胞结构如图2所示,其中Cl原子的配位数为4.
分析 (1)根据铜的原子序数为29,结合能量最低原理书写基态原子的电子排布式;
(2)根据SO2晶体为分子晶体,而CuCl晶体为离子晶体比较熔点高低;根据判断SO2分子含有的δ键以及孤电子对数判断空间构型;
(3)根据价层电子对数判断乙二胺分子中氮原子的杂化类型,根据是否含有氢键分析二者熔沸点高低;
(4)根据成键原子的特点判断化学键类型;
(5)根据晶体结构特点分析Cl原子的配位数.
解答 解:(1)铜的原子序数为29,根据能量最低原理其态原子的电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1,故答案为:1s22s22p63s23p63d104s1或[Ar]3d104s1;
(2)因为SO2晶体为分子晶体,而CuCl晶体为离子晶体,所以SO2晶体的熔点比CuCl晶体低;SO2分子中含有2个δ键,孤电子对数=$\frac{6-2×2}{2}$=1,所以分子为V形;
故答案为:低;V形;
(3)乙二胺分子中氮原子形成4个δ键,价层电子对数为4,氮原子为sp3杂化,乙二胺分子间可以形成氢键,物质的熔沸点较高,而三甲胺分子间不能形成氢键,熔沸点较低,
故答案为:sp3杂化;高;
(4)②中所形成的配离子中含有的化学键中N与Cu之间为配位键,C-C键为非极性键,C-N、N-H、C-H键为极性键,不含离子键,故答案为:abd;
(5)从CuCl的晶胞可以判断,每个铜原子与4个Cl距离最近且相等,即Cu的配位数为4,根据化学式可知Cl的配位数也为4,故答案为:4.
点评 本题考查较为综合,涉及电子排布式、分子的立体构型、杂化轨道类型、氢键、化学键类型以及晶体结构分析等知识,题目具有一定难度,本题注意晶胞配位数的判断方法,可根据CuCl的化学式进行比较.

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目
18.决定化学反应速率的主要因素是( )
| A. | 反应物的浓度 | B. | 温度、压强以及反应物的接触面积 | ||
| C. | 催化剂 | D. | 参加反应的物质本身的性质 |
16.下列物质既能与盐酸反应,又能与烧碱溶液反应的是( )
①Al2O3 ②Al(OH)3 ③Al ④NaHCO3 ⑤NaHS ⑥CaCO3 ⑦NaHSO4 ⑧(NH4)2CO3.
①Al2O3 ②Al(OH)3 ③Al ④NaHCO3 ⑤NaHS ⑥CaCO3 ⑦NaHSO4 ⑧(NH4)2CO3.
| A. | 除⑥外 | B. | 除⑥、⑦外 | C. | 除⑥、⑦、⑧外 | D. | 除①、②、③、④、⑤外 |
3.下列各组大小顺序不正确的是( )
| A. | 粒子半径:Na+>Mg2+>S2->Cl- | B. | 热稳定性:SiH4<PH3<H2S<HCl | ||
| C. | 碱性强弱:KOH>NaOH>LiOH | D. | 还原性:HF<HCl<HBr<HI |
13.下列四个实验中,结论正确的是( )
| A. | 有一澄清的碱性溶液,做离子鉴定时得出的结论是含有:Al(OH)4-、Fe3+、HCO3- | |
| B. | 某一固体溶于水后,检验出含有K+、NO3-、Na+、Cl-等离子,则该固体混合物是KNO3和NaCl的混合物或KCl和NaNO3的混合物 | |
| C. | 固体NaOH吸收了空气中的二氧化碳并溶于水后,则溶液中就一定大量存在碳酸根离子 | |
| D. | 加热碳酸氢铵固体,将生成的气体通过碱石灰能制备NH3 |
20.有关杂化轨道的说法不正确的是( )
| A. | 杂化前后的轨道数不变,但轨道的形状发生了改变 | |
| B. | sp3、sp2、sp杂化轨道的夹角分别为109°28′、120°、180° | |
| C. | 部分四面体形、三角锥形、V形分子的结构可以用sp3杂化轨道解释 | |
| D. | 杂化轨道全部参加形成化学键 |
 .
.