题目内容
4. 在某恒容的密闭容器中,可逆反应A(g)+B(g)?xC(g)有如图所示的关系曲线,下列说法正确的是( )
在某恒容的密闭容器中,可逆反应A(g)+B(g)?xC(g)有如图所示的关系曲线,下列说法正确的是( )| A. | 温度:T1>T2 | B. | 压强:p1>p2 | ||
| C. | 正反应是放热反应 | D. | x的值是2 |
分析 根据“先拐先平数值大”知p1、p2及T1、T2的相对大小,升高温度,平衡向吸热反应方向移动,增大压强,平衡向气体体积减小的方向移动,根据压强改变、温度改变时C含量的变化确定x值、反应热,据此分析解答.
解答 解:A.温度越高反应速率越快,则反应到达平衡的时间越短,根据“先拐先平数值大”知T1<T2,故A错误;
B.压强越大,反应速率越快,则反应到达平衡的时间越短,根据“先拐先平数值大”知p1>p2,故B正确;
C.相同压强下,升高温度,C的含量增大,说明平衡向正反应方向移动,则正反应是吸热反应,故C错误;
D.相同温度下,增大压强,C的含量增大,平衡向正反应方向移动,则x=1,故D错误;
故选B.
点评 本题考查了图象分析,明确“先拐先平数值大”的含义是解本题关键,再结合温度、压强对化学平衡的影响分析解答,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.下列化学用语表述正确的是( )
| A. | 羟基的电子式: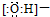 | B. | 硫原子的原子结构示意图: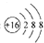 | ||
| C. | 乙烯分子的实验式:C2H4 | D. | 3,3一二甲基一1一戊烯的键线式: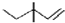 |
8.根据表中信息判断,下列选项不正确的是( )
| 序号 | 反应物 | 产物 |
| ① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4 |
| ② | Cl2、FeBr2 | FeCl3、FeBr3 |
| ③ | MnO4- | Cl2、Mn2+ |
| A. | 第①组反应的其余产物为H2O和 O2 | |
| B. | 氧化性由强到弱顺序为MnO4->Cl2>Fe3+>Br2 | |
| C. | 第③组反应中生成1mol Cl2,转移电子2mol | |
| D. | 第②组反应中Cl2与 FeBr2的物质的量之比为1:2 |
9.对于原子半径的理解,不正确的是( )
| A. | 同周期元素(除了稀有气体元素外),从左到右,原子半径依次减小 | |
| B. | 对于第三周期元素,从钠到氯,原子半径依次减小 | |
| C. | 各元素的原子半径总比其离子半径大 | |
| D. | 阴离子的半径大于其原子半径,阳离子的半径小于其原子半径 |
16.金刚石和石墨都是碳的单质,石墨在一定条件下可以转化为金刚石.已知12g石墨完全转化为金刚石时,要吸收QkJ的能量,下列说法正确的是( )
| A. | 金刚石与石墨互为同位素 | |
| B. | 石墨石稳定 | |
| C. | 金刚石稳定 | |
| D. | 等质量的石墨与金刚石完全燃烧,石墨放出的能量多 |
13.下列各组物质中不互为同分异构体的是( )
| A. | 葡萄糖和果糖 | B. | 乙醇和乙醚 | C. | 蔗糖和麦芽糖 | D. | 乙酸和甲酸甲酯 |
14.在足量的稀氯化亚铁溶液中加入1~2滴液溴,振荡后溶液变为黄色.为了探究溶液变为黄色的原因,甲、乙两位同学提出了不同的观点:
(1)甲同学认为是:Br2溶于水变成黄色溶液;乙认为是:Fe2+被氧化成Fe3+使溶液变成黄色.
(2)现提供试剂:酸性高锰酸钾溶液、氢氧化钠溶液、四氯化碳、硫氰化钾溶液
并用两种方法加以验证,写出选用的试剂编号及实验中观察到的现象:
(3)若选用淀粉碘化钾溶液判断哪位同学的推断正确,是否可行?(填“可行”或不可行)不可行;,理由是因为Br2和Fe3+都能把I-氧化成I2
(4)向稀溴化亚铁溶液中通入过量氯气的离子反应方程式:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-.
(1)甲同学认为是:Br2溶于水变成黄色溶液;乙认为是:Fe2+被氧化成Fe3+使溶液变成黄色.
(2)现提供试剂:酸性高锰酸钾溶液、氢氧化钠溶液、四氯化碳、硫氰化钾溶液
并用两种方法加以验证,写出选用的试剂编号及实验中观察到的现象:
| 选用试剂 | 实验现象 | |
| 第一种方法 | 四氯化碳 | |
| 第二种方法 | 硫氰化钾溶液 |
(4)向稀溴化亚铁溶液中通入过量氯气的离子反应方程式:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-.