��Ŀ����
����Ŀ������ˮ��ɽ���ǽ�ɽ��ɽ���ѳ�Ϊ���صı��ơ�
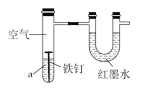
��1�����Ṥҵ�ų���β������Ҫ��SO2���ж��ִ�����ʽ
�����������п����������Ṥҵβ������___
a������Na2SO3��Һ b������NaCl��Һ c��ϡH2SO4 d��Ũ��ˮ
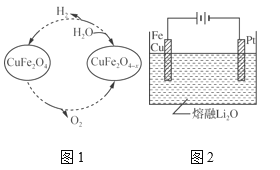
�����Ṥҵ�ų���β��Ҳ�������̿���Ҫ�ɷ�ΪMnO2�����գ�����MnSO4��д����Ӧ�Ļ�ѧ����ʽ___��
��2����������β����NO��CO�ķ���֮һ������������������װһ����ת��װ�ã�ʹNO��CO�ڴ���������ת��Ϊ�����ʡ�д���÷�Ӧ�Ļ�ѧ����ʽ��___��
��3����NaOH��Һ��������շ����еĵ��������ѧ����ʽ����NO+NO2+2NaOH=2NaNO2+H2O��2NO2+2NaOH=NaNO2+NaNO3+H2O
����������Ӧ�зֱ����ĵ�����NO2ʱ��ת�Ƶ��ӵ����ʵ���֮��Ϊ___��
�ڱ�״����5.6L������壨ֻ��NO��NO2����0.5molL��1NaOH��Һ��ȫ���գ�������ҪNaOH��Һ�����Ϊ___L��
���𰸡�d SO2+MnO2=MnSO4 2CO+2NO![]() 2CO2+N2 2��1 0.5
2CO2+N2 2��1 0.5
��������
��1���٣����Ṥҵβ����Ҫ�ɷ�Ϊ�����������������Ϊ����������ݴ˷���ѡ��������Һ��
�ڣ��������̺Ͷ�������Ӧ���������̣�
��2��ʹNO��CO�ڴ���������ת��Ϊ������Ϊ������̼�͵�����
��3���٣�![]() ��Ӧ������1mol������������ת��1mol���ӣ�2NO2+2NaOH��NaNO2+NaNO3+H2O��Ӧ������1mol��������������ת��1mol���ӣ�
��Ӧ������1mol������������ת��1mol���ӣ�2NO2+2NaOH��NaNO2+NaNO3+H2O��Ӧ������1mol��������������ת��1mol���ӣ�
�ڣ���״����5.6L�������(ֻ��NO ��NO2)���ʵ���=![]() =0.25mol���� 0.5molL��1NaOH��Һ��ȫ���գ��������Σ����Ԫ���غ����������ҪNaOH��Һ�������
=0.25mol���� 0.5molL��1NaOH��Һ��ȫ���գ��������Σ����Ԫ���غ����������ҪNaOH��Һ�������
��1����a������Na2SO3��Һ���ն��������٣���a����
b������NaCl��Һ�������ն�����������Ϊ���ն�������������Լ�����b����
c��ϡH2SO4�������ն�����������Ϊ���ն�������������Լ�����c����
d��������ˮ����β����������Ӧ������������狀�ˮ���ù�����ˮ����β�������ӷ���ʽΪ��SO2+2NH3H2O��2NH4++SO32��+H2O����d��ȷ��
�ʴ�Ϊ��d��
�ڣ�β��Ҳ�������̿�MnO2�����գ��������̺Ͷ�������Ӧ���������̣�ͼ1��ʾ����Ӧ1���Ļ�ѧ����ʽΪ��SO2+MnO2��MnSO4���ʴ�Ϊ��SO2+MnO2��MnSO4��
��2����������β����NO��CO�ķ���֮һ������������������װһ����ת��װ�ã�ʹNO��CO�ڴ���������ת��Ϊ������Ϊ�����Ͷ�����̼����Ӧ�Ļ�ѧ����ʽΪ��2CO+2NO![]() 2CO2+N2���ʴ�Ϊ��2CO+2NO
2CO2+N2���ʴ�Ϊ��2CO+2NO![]() 2CO2+N2��
2CO2+N2��
��3���٣�NO+NO2+2 NaOH��2NaNO2+H 2O����Ӧ������1mol������������ת��1mol���ӣ�2NO2+2NaOH��NaNO2+NaNO3+H2O����Ӧ������2mol��������������ת��
1mol������Ӧ�зֱ����ĵ�����NO2ʱ��ת�Ƶ��ӵ����ʵ���֮�ȣ�2��1���ʴ�Ϊ��2��1��
�ڣ���״����5.6L������壨ֻ��NO��NO2�����ʵ�����![]() ��0.25mol����0.5molL��1NaOH��Һ��ȫ���գ��������Σ�Na��N��1:1�����Ԫ���غ���㣬�����������ʵ���Ϊ0.25mol��������ҪNaOH��Һ�����V��
��0.25mol����0.5molL��1NaOH��Һ��ȫ���գ��������Σ�Na��N��1:1�����Ԫ���غ���㣬�����������ʵ���Ϊ0.25mol��������ҪNaOH��Һ�����V��![]() ��0.5L���ʴ�Ϊ��0.5��
��0.5L���ʴ�Ϊ��0.5��

����Ŀ����֪��pAg��-lgc(Ag+)��pX��-lg c(Xn-)��298Kʱ���������ʵ�Ksp���±���
��ѧʽ | AgCl | AgSCN | Ag2CrO4 |
��ɫ | �� | dz�� | �� |
Ksp | 1.8��1010 | 1.0��1012 | 2.0��1012 |
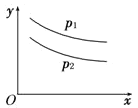
AgCl��AgSCN��Ag2CrO4�ı�����Һ�У������Ӻ������ӵ�Ũ�ȹ�ϵ��ͼ��ʾ������˵����ȷ����
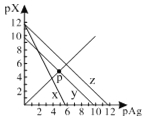
A.ͼ��x����AgCl���ߣ�z����AgSCN����
B.298Kʱ����Cl����CrO42�������ʵ���Ũ�Ⱦ�Ϊ0.1mol/L����Һ�У���������0.1mol/L��AgNO3��Һ�����Ȳ������Ǻ�ɫ����
C.298Kʱ������p���������Ũ�ȣ���y�ϵĵ������������ƶ�
D.298KʱAg2CrO4(s)��2SCN��(aq) ![]() 2AgSCN(s)��CrO42- (aq)��ƽ�ⳣ��K��2.0��1012
2AgSCN(s)��CrO42- (aq)��ƽ�ⳣ��K��2.0��1012