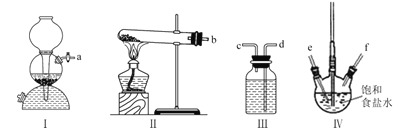
��Ŀ����
����Ŀ��(1)����˫��ˮ��������̿�(��Ҫ�ɷ���MnO2)�Ľ����ʣ���ת����Mn2+��д������������˫��ˮ������̿�����ʵ����ӷ���ʽ��_________��
(2)�����������Ʒ�Ӧ���������к���IO3-��д����Ӧ���̵����ӷ���ʽ��___��
(3) ��������е�Cr2O3������Na2CO3�ڿ����б��գ�Cr2O3������ΪNa2CrO4������CO2�ݳ���д���÷�Ӧ�Ļ�ѧ����ʽ��_____________��
(4)ij����С����ʵ�����ý�Ũ��KOH��Һֱ�������������о����ַ�Ӧ����һ��ʱ���ʼ����KClO3�������࣬����KClO3�����ӷ���ʽ��_______��
(5) ����ȱλ����ͭ(CuFe2O4��x)������������̫�����Ȼ�ѧѭ���ֽ�H2OҲ����H2��������ת����ͼ1��ʾ��
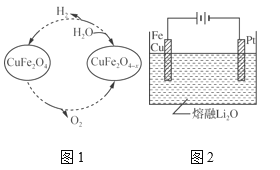
����ȱλ����ͭ(CuFe2O4��x)��ˮ��Ӧ�Ļ�ѧ����ʽΪ_________��
��CuFe2O4���õ绯ѧ�����õ�����ԭ����ͼ2��ʾ���������ĵ缫��ӦʽΪ_________��
���𰸡�MnO2+H2O2+2H+![]() Mn2++2H2O+O2�� 3I2+6OH-
Mn2++2H2O+O2�� 3I2+6OH-![]() 5I-+IO3-+3H2O 2Cr2O3+4Na2CO3+3O2
5I-+IO3-+3H2O 2Cr2O3+4Na2CO3+3O2![]() 4Na2CrO4+4CO2 6OH-+3Cl2=5Cl-+ClO3-+3H2O CuFe2O4��x��x H2O= CuFe2O4 ��x H2 Cu��2Fe��4O2- -8e-= CuFe2O4
4Na2CrO4+4CO2 6OH-+3Cl2=5Cl-+ClO3-+3H2O CuFe2O4��x��x H2O= CuFe2O4 ��x H2 Cu��2Fe��4O2- -8e-= CuFe2O4
��������
������������MnO2��H2O2��Ӧ����O2��H2O��Mn2+��
�Ƶ����������ʾ��������ԣ������������Ʒ����绯��Ӧ��������IO3-�⣬������I-��
��Cr2O3�ڿ����б�����ΪNa2CrO4������Ϊ��������
��������KOH��Һ��Ӧ������KClO3�����������绯������Cl-���ɣ�
�ɢ�CuFe2O4��x��ˮ��Ӧ����������CuFe2O4��
�ڵ�������������������Ӧ����������Ϣ��֪��������Fe��Cuʧ���Ӻ������ӷ�Ӧ����CuFe2O4��
��������������H2O2��MnO2����ΪO2��MnO2����ԭΪMn2+�����ݵ�ʧ�����غ㡢����غ㡢ԭ���غ㣬�÷�Ӧ�����ӷ���ʽΪ��MnO2+H2O2+2H+=Mn2++O2��+2H2O��
���ɷ�����֪�����������Ʒ����绯��Ӧ����IO3-��I-�����ݵ�ʧ�����غ㡢����غ㡢ԭ���غ�д���÷�Ӧ�����ӷ���ʽΪ��3I2+6OH-=5I-+IO3-+3H2O��
���ɷ�����֪��Cr2O3������Na2CO3�ڿ����б��գ�Cr2O3������ΪNa2CrO4������CO2�ݳ��������е�����Ϊ�����������ݵ�ʧ�����غ㡢�����غ�д���÷�Ӧ�Ļ�ѧ����ʽΪ��2Cr2O3+4Na2CO3+3O2![]() 4Na2CrO4+4CO2��
4Na2CrO4+4CO2��
��������KOH��Һ��Ӧ�����������绯����ClO3-��Cl-�����ݵ�ʧ�����غ㡢����غ㡢ԭ���غ�д���÷�Ӧ�����ӷ���ʽΪ��6OH-+3Cl2=5Cl-+ClO3-+3H2O��
�ɢ���ͼ��֪CuFe2O4��x��ˮ��Ӧ����������CuFe2O4�����ݵ�ʧ�����غ㡢�����غ�д����ѧ����ʽΪ��CuFe2O4��x��x H2O= CuFe2O4 ��x H2��
��������Fe��Cuʧ���Ӻ������ӷ�Ӧ����CuFe2O4��������ӦʽΪ��Cu��2Fe��4O2--8e-=CuFe2O4

 ��У����ϵ�д�
��У����ϵ�д�