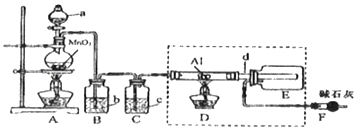
题目内容
【题目】“绿水青山就是金山银山”,近年来我国着力推进绿色发展、循环发展等,形成节约资源和环境保护的空间格局。
Ⅰ.为了寻求对环境无污染燃料燃烧法,有人曾研究了在标准条件下氮的氧化物与碳的氧化物相互作用的机理。
(1)确定该反应的反应过程如下:
第一步:NO2(g)+CO(g)→O—N…O…C…O—O △H=+134kJ/mol
第二步:O—N…O…C—O→NO(g)+CO2(g) △H=-368kJ/mol
总反应式:NO2(g)+CO(g)→NO(g)+CO2(g) △H=___kJ/mol
(2)对于任意一个化学反应,通过实验可以确定其反应速率与反应物浓度的定量关系:γ=kcm(NO2)·cn(CO),该方程称为速率方程,其中k称为速率常数。分析表中数据,写出该反应的速率方程表达式:___。

II.活性炭也可处理大气污染物NO,其原理:2NO(g)+C(s)![]() CO2(g)+N2(g) △H>0。在T℃时,在容积一定的刚性容器中加入NO气体和活性炭粉,使之发生反应测得各物质的物质的量如下:
CO2(g)+N2(g) △H>0。在T℃时,在容积一定的刚性容器中加入NO气体和活性炭粉,使之发生反应测得各物质的物质的量如下:
![]()
(3)计算T℃时,该反应的平衡常数K=___。
(4)为了提高NO的转化率和反应速率,可采取的措施有___(填字母)。
A.增加NO的用量 B.增加活性炭的用量
C.升高温度 D.增大体系压强
Ⅲ.用间接电化学法可对大气污染物NO进行无害化处理,其工作原理如图所示。

(5)电极I电极反应式为___。
(6)电解时H+的移动方向___(填“从左向右”、“从右向左”或“不移动”)
(7)标况下,每处理1molNO的同时,可产生O2的体积___L。
【答案】-234 γ=4.0×10-3·c2(NO2) ![]() C 2HSO3-+2e-+2H+=S2O42-+2H2O 从右向左 11.2
C 2HSO3-+2e-+2H+=S2O42-+2H2O 从右向左 11.2
【解析】
(1)根据盖斯定律,将第一步反应+第二步反应计算;
(2)根据实验2、3知,CO(g)的浓度变成原来的2倍,反应速率不变,说明该反应速率与c(CO)无关;根据实验1、2或3、4知,NO2(g)浓度变成原来的2倍,反应速率变成原来的4倍,因此反应速率与c2(NO2)成正比,结合实验数据计算解答;
(3)假设容器的体积为VL,根据表格数据,平衡时,c(NO)=![]() mol/L,c(N2)=
mol/L,c(N2)=![]() mol/L,c(CO2)=
mol/L,c(CO2)=![]() mol/L,据此计算该反应的平衡常数K;
mol/L,据此计算该反应的平衡常数K;
(4)根据温度、压强和浓度对反应速率和化学平衡的影响分析判断;
(5)HSO3-在电极I上转化为S2O42-,过程中S的化合价降低,得到电子发生还原反应,则电极I为阴极,则电极Ⅱ为阳极,电解池中阳离子向阴极移动,结合电解池原理和得失电子守恒分析解答(5)~(7)。
(1)第一步:NO2(g)+CO(g)→O—N…O…C…O—O △H=+134kJ/mol,第二步:O—N…O…C—O→NO(g)+CO2(g) △H=-368kJ/mol,根据盖斯定律,将第一步反应+第二步反应得:NO2(g)+CO(g)→NO(g)+CO2(g) △H=(+134kJ/mol)+(-368kJ/mol)=-234kJ/mol,故答案为:-234;
(2)根据实验2、3知,CO(g)的浓度变成原来的2倍,反应速率不变,说明该反应速率与c(CO)无关;根据实验1、2或3、4知,NO2(g)浓度变成原来的2倍,反应速率变成原来的4倍,因此反应速率与c2(NO2)成正比;则γ=kc2(NO2),将实验2的数据代入,得到k=4.0×10-3,因此γ=4.0×10-3·c2(NO2),故答案为:γ=4.0×10-3·c2(NO2);
(3)假设容器的体积为VL,根据表格数据,平衡时,c(NO)=![]() mol/L,c(N2)=
mol/L,c(N2)=![]() mol/L,c(CO2)=
mol/L,c(CO2)=![]() mol/L,该反应的平衡常数K=
mol/L,该反应的平衡常数K=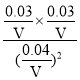 =
=![]() ,故答案为:
,故答案为:![]() ;
;
(4)A.增加NO的用量,NO的转化率降低,错误;B.增加活性炭的用量,不能改变平衡的移动和增大化学反应速率,错误;
C.升高温度,反应速率加快,平衡正向移动,NO的转化率增大,正确;D.增大体系压强,该平衡不移动,不能增大NO的转化率,错误;故答案为:C;
(5)根据图示,HSO3-在电极I上转化为S2O42-,过程中S的化合价降低,得到电子发生还原反应,则电极I为阴极,电极反应式为:2HSO3-+2e-+2H+═S2O42-+2H2O,故答案为:2HSO3-+2e-+2H+═S2O42-+2H2O;
(6)电极I
(7)电极Ⅱ为阳极,H2O在电极Ⅱ上被转化为O2,发生电极反应:2H2O-4e-═O2↑+4H+,每处理1 mol NO转化生成0.5molN2,则转移电子数为1mol×2=2mol,根据电子转移守恒,则产生O2的物质的量为2mol×![]() =0.5mol,在标准状况下的体积为0.5mol×22.4L/mol=11.2L,故答案为:11.2。
=0.5mol,在标准状况下的体积为0.5mol×22.4L/mol=11.2L,故答案为:11.2。

【题目】根据下列实验操作、现象所得出的结论正确的是( )
实验操作 | 现象 | 结论 | |
A | 向氯水中滴加硝酸酸化的AgNO3溶液 | 产生白色沉淀 | 氯水中含有Cl﹣ |
B | 向某溶液中滴加盐酸 | 有无色气体产生 | 溶液中一定有CO32﹣ |
C | 向某溶液中加入烧碱溶液后加热,用湿润的红色石蕊试纸检验 | 石蕊试纸变蓝 | 溶液中有NH4+ |
D | 将SO2通入到酸性KMnO4溶液中 | 溶液紫红色褪去 | SO2具有漂白性 |
A.AB.BC.CD.D